题目内容
高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应的离子方程式: 。
(2)高锰酸钾可代替二氧化锰用来制取Cl2,则反应中氧化剂和还原剂的物质的量之比为 。
(3)高锰酸钾与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O。若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生转移的电子数目为 。
(1)2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
(2)1∶5 (3)0.15NA(或9.03×1022)
【解析】(1)MnO4-→Mn2+为还原过程,故与之对应的应为氧化过程C2O42-→CO2。根据得失电子守恒将方程式配平即可。(2)酸性条件下,KMnO4溶液的氧化性较强,其与浓盐酸反应时,被还原为Mn2+,根据电子守恒可知氧化剂和还原剂(HCl)物质的量之比为1∶5。(3)根据方程式可得关系式:
10FeS ~ 10S ~ Δm ~ e-
880 g 320 g 560 g 30 mol
2.8 g n(e-)
n(e-)=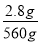 ×30 mol=0.15 mol。
×30 mol=0.15 mol。

甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含的离子如下表所示:
阳离子 | NH4+、Na+、Mg2+ |
阴离子 | OH-、NO3—、SO42— |
取等质量的三种化合物配制成相同体积的溶液,其溶质的物质的量浓度:c(甲)>c(乙)>c(丙)。
(1)甲是________,向AlCl3溶液中逐滴加入甲溶液,观察到的现象是________,对应的离子方程式为________。
(2)乙是______,设计实验确定乙的物质组成________(若乙已确定,则不填该空)。
某无色溶液含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32—、⑥SO42—中的
若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤 | 操作 | 现象 |
(1) | 用pH试纸检验 | 溶液的pH大于7 |
(2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
(3) | 向所得水溶液中加入Ba(NO3)2溶液和稀硝酸 | 有白色沉淀产生 |
(4) | 过滤,向滤液中加入AgNO3溶液和稀硝酸 | 有白色沉淀产生 |
下列结论正确的是( )
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑥
C.不能确定的离子是①
D.不能确定的离子是③⑤
下列实验操作正确且能达到预期目的的是( )
| 实验目的 | 操作 |
① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
⑤ | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
A.①④⑤ B.②③⑤ C.①⑤⑥ D.①②③④⑤⑥