题目内容
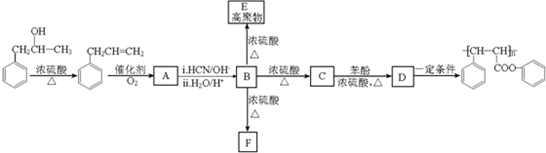
17.氯化铝在石油工业中有重要作用.研究性学习小组为了研究氯化铝的制取方法,查阅相关资料,得知氯化铝在170℃时升华,易在空气中潮解产生大量白雾.现有试剂:浓盐酸、二氧化锰、铝粉、氢氧化钠溶液、浓硫酸、饱和氯化钠溶、蒸馏水.他们设计如图装置: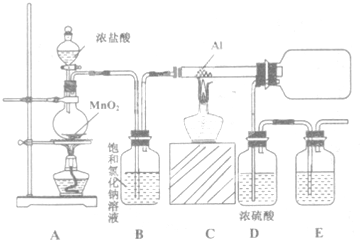
回答下列问题:
(1)A装置中反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)若得到干燥、纯净的氯气,该实验设计存在缺陷.在B和C间需补充必要的实验装置.补充的装置中应放的试剂是浓硫酸,其作用是干燥氯气;B中饱和氯化钠溶液的作用是吸收氯化氢气体.
(3)实验开始时,先点燃A处酒精灯(填“A”或“C”),当玻璃管内充满黄绿色气体时再点燃另一处酒精灯.
(4)E中的试剂是氢氧化钠溶液,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(5)当A中产生氯气1.12L(标准状况下)时,被氧化的HCl3.65g,共有0.1mol•e-发生转移.
分析 A装置中浓盐酸和二氧化锰反应生成氯气,B中的饱和食盐水是为了除去混有的HCl气体,C中氯气与铝反应生成氯化铝,因为氯化铝易发生水解,故D应该防止空气中的水蒸气进入C装置,用E装置吸收尾气,
(1)A装置中是用浓盐酸与二氧化锰加热生成氯气;
(2)因为氯化铝容易水解,用浓盐酸与二氧化锰加热生成氯气中含有氯化氢和水蒸气杂质,所以要除去,装置中只有饱和氯化钠溶液可以除去氯化氢,还在再加一个干燥装置,除去氯气中的水蒸气;
(3)实验开始时,要先用氯气将装置中的空气排除,以防止空气中的氧气与铝反应;
(4)实验中有部分未反应的氯气在尾气中会污染空气,所以要吸收,通常用碱溶液例如氢氧化钠吸收;
(5)根据二氧化锰与浓盐酸反应可知,浓盐酸中的氯被氧化,从-1价升为0价,根据元素守恒和电子守恒计算.
解答 解:A装置中浓盐酸和二氧化锰反应生成氯气,B中的饱和食盐水是为了除去混有的HCl气体,C中氯气与铝反应生成氯化铝,因为氯化铝易发生水解,故D应该防止空气中的水蒸气进入C装置,用E装置吸收尾气,
(1)A装置中是用浓盐酸与二氧化锰加热生成氯气,反应的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)因为氯化铝容易水解,用浓盐酸与二氧化锰加热生成氯气中含有氯化氢和水蒸气杂质,所以要除去,装置中只有饱和氯化钠溶液可以除去氯化氢,还在再加一个干燥装置,除去氯气中的水蒸气,所以若得到干燥、纯净的氯气,在B和C间需补充必要的实验装置中应放的试剂是浓硫酸,其作用是干燥氯气;B中饱和氯化钠溶液的作用是吸收氯化氢气体,
故答案为:浓硫酸;干燥氯气;吸收氯化氢气体;
(3)实验开始时,要先用氯气将装置中的空气排除,以防止空气中的氧气与铝反应,所以实验开始时,先点燃A处酒精灯,当玻璃管内充满黄绿色气体时再点燃另一处酒精灯,
故答案为:A;玻璃管内充满黄绿色气体;
(4)实验中有部分未反应的氯气在尾气中会污染空气,所以要吸收,通常用碱溶液例如氢氧化钠溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:氢氧化钠溶液;Cl2+2OH-=Cl-+ClO-+H2O;
(5)根据二氧化锰与浓盐酸反应可知,浓盐酸中的氯被氧化,从-1价升为0价,当A中产生氯气1.12L(标准状况下)即0.05mol时,被氧化的HCl应为0.1mol,其质量为3.65g,共有0.1mol•e-发生转移,
故答案为:3.65;0.1.
点评 本题考查了制备无水FeCl3实验操作和实验设计,题目难度中等,侧重考查氯及其化合物的性质应用、实验基本操作的分析判断,试题综合性较强,有利于培养学生灵活应用基础知识的能力.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案| A. | Q2=2 Q1 | B. | 2Q1<Q2 | C. | Q1<Q2<92.4 kJ | D. | Q1=Q2<92.4 kJ |
| A. | 新制氯水放置数天,溶液中的Cl2分子数目不变 | |
| B. | 久置的氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 钠长时间露置于空气中,最终得到Na2CO3粉末 | |
| D. | 钠投入硫酸铜溶液中有红色粉末产生 |
| A. | Cu$\stackrel{{H}_{2}S{O}_{4}}{→}$CuSO4$\stackrel{Ba(N{O}_{3})_{2}}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{{O}_{2}}{→}$CuO$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 | |
| C. | Cu$\stackrel{{O}_{2}}{→}$CuO$\stackrel{{H}_{2}O}{→}$Cu(OH)2$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 | |
| D. | Cu$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 |

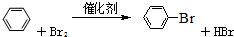
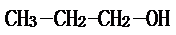 ;2-丙醇:
;2-丙醇: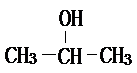 .
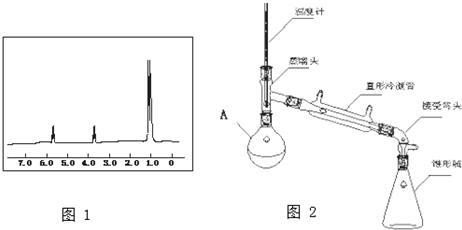
.
 苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H
苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H

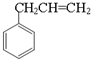
 .
. 生成A的化学方程式为
生成A的化学方程式为 +HCHO.
+HCHO.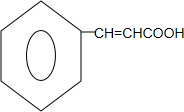 +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$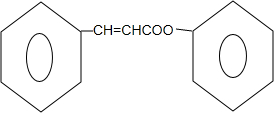 +H2O.
+H2O. (任写一种结构简式).
(任写一种结构简式).