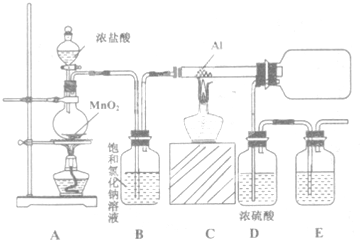
题目内容
6.(1)常温下,已知0.1mol•L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8.①常温下,0.1mol•L-1 HA溶液的pH=3;写出该酸(HA)与NaOH溶液反应的离子方程式:HA+OH-═A-+H2O;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:c(A-)>c(Na+)>c(H+)>c(OH-);
③0.2mol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合后所得溶液中:
c(H+)+c(HA)-c(OH-)=0.05mol•L-1.(溶液体积变化忽略不计)
(2)为实现以下各步的转化,请在括号内填入适当试剂的化学式

分析 (1)①0.1mol•L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8,则c(OH-)=10-11mol/L,c(H+)=1.0×10-3mol/L,依据pH=-lgc(H+)计算该溶液的pH;根据计算判断HA为弱电解质,然后写出其与氢氧化钠溶液的反应的离子方程式;
②根据酸和碱的物质的量的相对大小确定溶液中的溶质,从而确定溶液的酸碱性,结合电离平衡、水解平衡、电荷守恒等确定溶液中各种离子浓度的相对大小;
③根据电荷守恒与物料守恒进行计算.
(2)根据官能团的性质以及变化判断反应条件,-COOH具有酸性,可与NaHCO3反应生成-COONa,注意酚羟基不与NaHCO3反应,-COONa与HCl或H2SO4等强酸反应又可生成-COOH,酚羟基与NaOH或Na2CO3 反应生成酚羟基钠,醇羟基与金属钠反应,以此判断.
解答 解:(1)①0.1mol•L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8,根据水的离子积可得:c(OH-)=10-11mol/L、c(H+)=1.0×10-3mol/L,该溶液的pH=-lgc(H+)=3;说明HA在溶液中只能部分电离出氢离子,则HA为弱酸,该酸(HA)与NaOH溶液反应的离子方程式为:HA+OH-=A-+H2O,
故答案为:3;HA+OH-=A-+H2O;
②常温下pH=11的NaOH溶液中c(OH-)=10-3mol•L-1,HA是弱酸,酸的浓度远远大于氢离子浓度,溶液中的溶质是酸和盐,溶液呈酸性,所以溶液中氢离子浓度大于氢氧根离子浓度,酸根离子浓度大于钠离子浓度,溶液中4种离子物质的量浓度大小关系为:c(A-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(A-)>c(Na+)>c(H+)>c(OH-);
②0.2mol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合后所得溶液中,由电荷守恒可得:c(Na+)+c(H+)=c(A-)+c(OH-),由物料守恒可得:2c(Na+)=c(A-)+c(HA),二者结合可得:c(H+)+c(HA)-c(OH-)=c(Na+)=$\frac{1}{2}$×0.1mol/L=0.05mol/L,
故答案为:0.05.
(2)根据官能团的性质以及变化判断反应条件,-COOH具有酸性,可与NaHCO3反应生成-COONa,注意酚羟基不与NaHCO3反应,-COONa与HCl或H2SO4等强酸反应又可生成-COOH,酚羟基与NaOH或Na2CO3 反应生成酚羟基钠,酚羟基钠可与CO2反应生成酚羟基,醇羟基与金属钠反应,所以加入的化学试剂为:①NaHCO3;②H2SO4或HCl;③NaOH或Na2CO3;④CO2;⑤CNa,
故答案为:①NaHCO3;②H2SO4或HCl;③NaOH或Na2CO3;④CO2;⑤CNa.
点评 本题考查了酸碱混合后溶液定性判断及溶液pH的计算、有机物的结构与性质,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒、盐的水解原理正确判断溶液中各离子浓度大小.

 名校课堂系列答案
名校课堂系列答案| A. | 5min内平均反应速率vA=0.15mol•L-1•min-1 | |
| B. | 当同时对原平衡体系升高一定温度和增加一定压强时,达平衡后,C的物质的量分数为60%,则该反应的正反应为放热反应 | |
| C. | 保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,则反应将向逆反应方向进行 | |
| D. | t℃,向2L密闭、恒容容器中加入等物质的量的A和B,反应达到平衡状态时,C的物质的量分数仍为60%,则加入A的物质的量为1.6mol |
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应的正反应是吸热反应 | |
| B. | 100℃时,向体积为V1L的恒容密闭容器中充入2mol CO和4mol H2,达到平衡时,CO的转化率为40%,则V1=12 | |
| C. | 250℃时,向体积为V2L的恒容密闭容器中充入3mol CO和3mol H2,达到平衡时,混合气体中CO的体积分数为50% | |
| D. | 250℃时,向体积为V2L的恒容密闭容器中充入3mol CO和3mol H2,达到平衡时,混合气体中CH3OH(g)的体积分数为62.5% |
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学试 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K14.3×10-7 K25.6×10-11 | 3.0×10-8 |
(l)物质的量浓度均为0.1mol•L-l的下列四种溶液:
a.Na2CO3溶液;b.NaClO溶液;c.CH3COONa溶液;d.NaHCO3溶液.
pH由大到小的顺序是A>B>D>C(填编号).
(2)常温下0.1mol•L-l的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
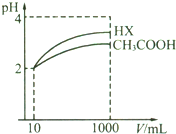
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如下图则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大稀释后,HX溶液中水电离出来的c(H+)大于 醋酸溶液中水电离出来的c(H+)无用填“大于”、“等于”或“小于”)理由是稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
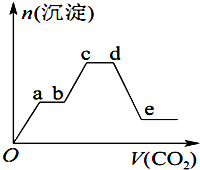 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )| A. | Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O | |
| B. | bc段与cd段所消耗CO2的体积相同 | |
| C. | bc段反应的离子方程式是2AlO${\;}_{2}^{-}$+3H2O+CO2═2Al(OH)3↓+CO${\;}_{3}^{2-}$ | |
| D. | de段沉淀减少是由于BaCO3固体的消失 |
| ①H2SO4溶液HSO4- | ②NaHSO4溶液HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温同压下)由大到小的顺序是③>②>①>④
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH,若终点时溶液pH=a,则由水电离的.c(H+)为10-amol/L.
(4)25℃时,将amol NH4NO3溶于水,溶液显酸性,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将逆向(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1.(NH3•H2O的电离平衡常数取Kb=2X10-5 mol•L-1)
 ⑤-CHO ⑥-H.
⑤-CHO ⑥-H.