题目内容
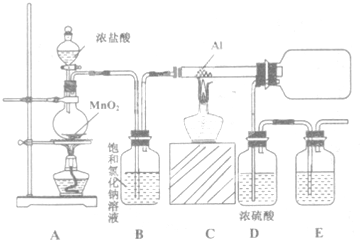
5.如图所示为苯和溴取代反应的实验改进后的装置图,其中A为具支试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉.
填写下列空白:?
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应.该反应中铁屑粉的作用是催化剂写出A中所发生反应的化学方程式(有机物写结构简式):
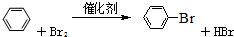
(2)试管C中苯的作用是吸收Br2蒸气;反应开始后,观察D和E两支试管,看到的现象为D、E液面上有白雾,D管中石蕊试液变红,E中有淡黄色沉淀生成
(3)F中发生反应的离子方程式为H++OH-=H2O
(4)在上述整套装置中,采取了防倒吸措施的装置是DEF(填字母代号).
分析 (1)苯和液溴在Fe作催化剂条件下能发生取代反应生成溴苯与HBr;
(2)溴易挥发,易溶液有机溶剂,用苯溶解溴,防止对D、E装置中反应干扰;该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸能使石蕊试液变红色;氢溴酸能和硝酸银反应生成淡黄色AgBr沉淀;
(3)F进行尾气处理,吸收HBr;
(4)HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸.
解答 解:(1)苯和液溴在Fe作催化剂条件下能发生取代反应生成溴苯与HBr,反应方程式为: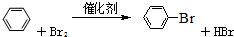 ,
,
故答案为:催化剂;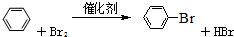 ;
;
(2)溴易挥发,易溶液有机溶剂,用苯吸收Br2蒸气,防止对D、E装置中反应的干扰;该反应中有溴化氢生成,能与水蒸气结合成氢溴酸液滴,液面上有白雾,溴化氢溶于水得到氢溴酸,氢溴酸是酸性物质,能使石蕊试液变红色,氢溴酸能和硝酸银反应生成淡黄色AgBr沉淀;
故答案为:吸收Br2蒸气;D、E液面上有白雾,D管中石蕊试液变红,E中有淡黄色沉淀生成;
(3)F进行尾气处理,吸收HBr,反应离子方程式为:H++OH-=H2O,
故答案为:H++OH-=H2O;
(4)HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸,装置D、E中导管口在液面上方,能防止倒吸,F中倒置漏斗增大了气体与氢氧化钠溶液的接触面积,有缓冲作用,能够防止倒吸,
故答案为:DEF.
点评 本题考查有机物实验制备,涉及溴苯的制取,侧重考查学生对装置与原理的分析评价,明确各个装置的作用及基本操作方法,难度不大.

练习册系列答案
相关题目
16.能正确表示下列反应的离子方程式是( )
| A. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 硫酸铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
14.下列叙述不正确的是( )
| A. | 1molH2质量为2g | B. | H2O的摩尔质量为18g | ||
| C. | 标况下44g CO2的体积为22.4L | D. | 9.8g H2SO4含1mol的H2SO4分子 |
1.某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):

关于该固体混合物,下列说法正确的是( )

关于该固体混合物,下列说法正确的是( )
| A. | 一定含有Al,其质量为4.5g | |
| B. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 | |
| C. | 一定含有MgCl2和FeCl2 | |
| D. | 一定不含FeCl2,可能含有MgCl2和AlCl3 |
14.t℃时,在2L密闭、恒压容器中充入1molA和1molB,发生反应:A(g)+B(g)?C(g). 5min后达到平衡,测得C的物质的量分数为60%,则下列说法正确的是( )
| A. | 5min内平均反应速率vA=0.15mol•L-1•min-1 | |
| B. | 当同时对原平衡体系升高一定温度和增加一定压强时,达平衡后,C的物质的量分数为60%,则该反应的正反应为放热反应 | |
| C. | 保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,则反应将向逆反应方向进行 | |
| D. | t℃,向2L密闭、恒容容器中加入等物质的量的A和B,反应达到平衡状态时,C的物质的量分数仍为60%,则加入A的物质的量为1.6mol |
15.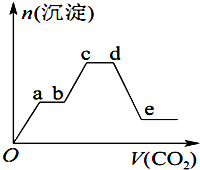 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )
 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )| A. | Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O | |
| B. | bc段与cd段所消耗CO2的体积相同 | |
| C. | bc段反应的离子方程式是2AlO${\;}_{2}^{-}$+3H2O+CO2═2Al(OH)3↓+CO${\;}_{3}^{2-}$ | |
| D. | de段沉淀减少是由于BaCO3固体的消失 |
 ⑤-CHO ⑥-H.
⑤-CHO ⑥-H.