题目内容
【题目】一定量的浓硝酸与足量铜在烧杯中充分反应,产生NO2、N2O4和NO的混合气体,这些气体若与1.12LO2(标准状况)混合后通入水中,则气体被水完全吸收。若继续向烧杯中加入5mol·L-1H2SO4溶液100mL,剩余的铜恰好被溶解,则Cu的总质量为( )
A.9.6gB.19.2gC.24gD.25.6g
【答案】D
【解析】
Cu和浓硝酸反应过程中,Cu失电子生成铜离子、硝酸得电子生成NO2、N2O4、NO,且转移电子守恒,这些气体若与1.12LO2(标况)混合后通入水中,气体被完全吸收,说明氧气得到的电子等于这些气体生成硝酸根离子失去的电子,所以氧气得到的电子等于Cu失去的电子,根据转移电子得n(Cu)=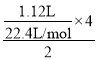 =0.1mol,硝酸溶解的铜的质量为0.1mol×64g/mol=6.4g,根据原子守恒得n(Cu)=n[Cu(NO3)2]=0.1mol,再加入稀硫酸后,相当于溶液中含有硝酸,能继续溶解Cu,n(H+)=2n(H2SO4)=2×5mol/L×0.1L=1mol,n(H+):n(NO3-)=1mol:0.2mol=5:1>
=0.1mol,硝酸溶解的铜的质量为0.1mol×64g/mol=6.4g,根据原子守恒得n(Cu)=n[Cu(NO3)2]=0.1mol,再加入稀硫酸后,相当于溶液中含有硝酸,能继续溶解Cu,n(H+)=2n(H2SO4)=2×5mol/L×0.1L=1mol,n(H+):n(NO3-)=1mol:0.2mol=5:1>![]() ,所以氢离子有剩余,根据硝酸根离子计算溶解铜的质量,设溶解Cu的质量为x,则:
,所以氢离子有剩余,根据硝酸根离子计算溶解铜的质量,设溶解Cu的质量为x,则:
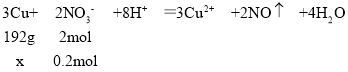
192g:2mol=x:0.2mol,解得x=19.2g,故反应过程中一共消耗铜的质量=19.2g+6.4g=25.6g。
答案选D。

【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-