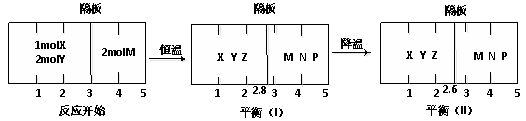
题目内容
【题目】燃料的使用和防污染是社会发展中一个无法回避的矛盾话题。
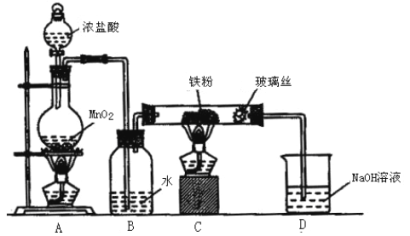
(1)我国北方冬季烧煤供暖所产生的废气是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)═N2(g)+2CO2(g) △H
若①N2(g)+O2(g)═2NO(g) △H1=+180.5 kJ·mol-1
②CO(g)═C(s)+![]() O2(g) △H2=+110.5 kJ·mol-1
O2(g) △H2=+110.5 kJ·mol-1
③C(s)+O2(g)═CO2(g) △H3=﹣393.5 kJ·mol-1
则△H= kJ·mol-1.
(2)甲醇可以补充和部分替代石油燃料,缓解能源紧张。一定条件下,在容积为VL的密闭容器中充入a molCO与2a mol H2合成甲醇,CO平衡转化率与温度、压强的关系如图所示。
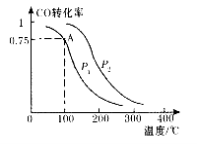
①P1_ P2(填“>” 、“<” 或“=” ),理由是
②该甲醇合成反应在A点的平衡常数K= (用a和V表示)。
③下列措施中能够同时满足增大反应速率和提高CO转化率的是 。(填写相应字母)
a、使用高效催化剂 b、降低反应温度 c、增大体系压强
d、不断将CH3OH从反应混合物中分离出来 e、增加等物质的量的CO和H2
(3)机动车的尾气也是雾霾形成的原因之一。

①近几年有人提出在催化剂条件下,利用汽油中挥发出来的C3H6催化还原尾气中的NO气体生成三种无污染的物质。请写出该过程的化学方程式: 。
②电化学气敏传感器法是测定汽车尾气常用的方法之一。其中CO传感器的工作原理如上图所示,则工作电极的反应式为 。
(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是 ,用文字和化学用语解释原因 。
【答案】(1)﹣746.5 kJ·mol-1
(2)① < 甲醇的合成反应是分子数减少的反应,相同温度下,增大压强CO的转化率提高;② ![]() ③ c
③ c
(3)①2C3H6+18NO=6CO2+6H2O+9N2 ②CO-2e-+H2O=CO2+2H+
(4)NH4HSO3 HSO3-![]() H+ +SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小。
H+ +SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小。
【解析】
试题分析:(1)根据盖斯定律,-①+②×2+③×2得-180.5+110.5×2-393.5×2=﹣746.5kJ·mol-1,则2NO(g)+2CO(g)═N2(g)+2CO2(g) △H=﹣746.5kJ·mol-1;
(2)①根据化学反应CO(g)+2H2(g)=CH3OH(g),甲醇的合成反应是分子数减少的反应,相同温度下,增大压强,CO的转化率提高,所以P1<P2;
②在A点CO的转化率为0.75,根据三段式
CO(g)+2H2(g)=CH3OH(g)
起始 a 2a 0
变化 0.75a 1.5a 0.75a
平衡 0.25a 0.5a 0.75a
则K=(0.75a÷V)/(0.5a÷V)2×(0.25a÷V)=12V2/a2 (mol·L-1)-2;
③a.使用高效催化剂只能加快化学反应速率,不符;b.降低反应温度,化学反应速率降低,平衡右移,CO的转化率增大,不符;c.增大体系压强,平衡正向移动,CO的转化率增大,化学反应速率加快,符合;d.不断将CH30H从反应混合物中分离出来,化学反应速率减慢,不符;e.增加等物质的量的CO和H2,相当于在1:2的基础上减少H2的物质的量,平衡逆向移动,CO的平衡转化率降低,不符;选c。
(3)①根据题意,C3H6催化还原尾气中的NO气体生成三种无污染的物质,这三种物质分别为氮气、二氧化碳和水蒸气,然后根据化合价升降相等和原子守恒配平,则该过程的化学方程式为2C3H6+18NO= 6CO2+6H2O+9N2;
②根据CO传感器的工作原理图可知,工作电极是CO失电子生成CO2,则工作电极的反应式为CO-2e-+H2O=CO2+2H+;
(4)根据HSO3-![]() H+ +SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小,所以相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3。
H+ +SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小,所以相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是NH4HSO3。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案