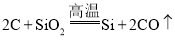题目内容
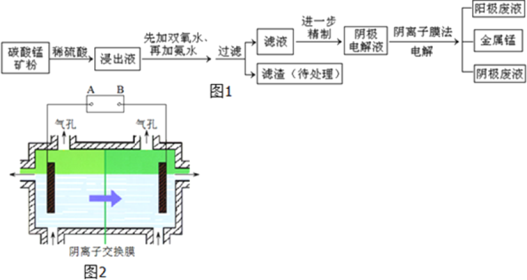
【题目】某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如图1:阴离子膜法电解装置如图2所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______.
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
加氨水调节溶液的pH等于6,则滤渣的成分是______,滤液中含有的阳离子有H+和______.
(3)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因______.
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的______极.实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为______.
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式______.
【答案】MnCO3+2H+=Mn2++CO2↑+H2O Al(OH)3、Fe(OH)3 Mn2+、Mg2+、NH4+ MnO2在酸性条件下被二价铁还原为Mn2+ 负 2H2O-4e-=O2↑+4H+ Mn2+-2e-+2H2O=MnO2+4H+
【解析】
将碳酸锰矿粉溶于稀硫酸中MnCO3、FeCO3、MgO、Al2O3都和稀硫酸反应生成硫酸盐,酸性条件下,MnO2被亚铁离子还原生成Mn2+,SiO2以沉淀析出,然后向浸出液中先加双氧水、再加氨水,并调节溶液的pH到6,根据表中数据可知,pH=6时,Al3+、Fe3+完全转化为沉淀,溶液中存在Mn2+、Mg2+、NH4+,则滤渣为Al(OH)3、Fe(OH)3,然后进一步精制,再利用阴离子交换膜电解,从而得到金属Mn。
(1)碳酸锰和稀硫酸反应生成硫酸锰、二氧化碳和水,离子方程式为MnCO3+2H+=Mn2++CO2↑+H2O;
(2)加入双氧水时将亚铁离子氧化为铁离子,根据氢氧化物沉淀需要的pH表知pH=6时,Al3+、Fe3+完全转化为沉淀,溶液中存在Mn2+、Mg2+、NH4+,则滤渣为Al(OH)3、Fe(OH)3;
(3)酸性条件下,MnO2被亚铁离子还原生成Mn2+,亚铁离子被氧化生成Fe3+,所以在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2;
(4)根据阴离子移动方向知,左边电极是阴极、右边电极是阳极,则连接阴极的电极A是电源负极,阳极上氢氧根离子放电生成氧气,电极反应式为2H2O-4e-=O2↑+4H+;
(5)锰离子不稳定,易被氧气氧化生成二氧化锰,所以阳极反应的副反应为Mn2+-2e-+2H2O=MnO2+4H+。

【题目】二氧化锗(GeO2)可用于制备半导体材料,某实验小组以铁矾渣(主要成分为FeO、CaO、GeO和SiO2等)为原料制取二氧化锗的工艺流程如下所示。
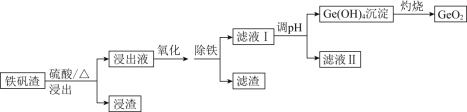
已知:25℃时,部分金属阳离子转化为氢氧化物沉淀时的pH如下表所示。
离子 | Fe3+ | Mn2+ | Ge4+ |
开始沉淀时的pH | 2.3 | 8.3 | 8.2 |
沉淀完全时的pH | 4.1 | 9.8 | 11.2 |
请回答下列问题:
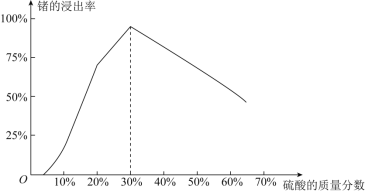
(1)由下图可知,“浸出”时,所用硫酸的最佳质量分数为________,浸渣的主要成分为________________(填化学式)。
(2)“氧化”时,可选用的试剂为________(填字母)。
A.KMnO4 B.NaOH C.H2O2 D.I2
(3)“氧化”时,若以适量稀硝酸作氧化剂,则Ge2+被氧化的离子方程式为________________。“氧化”后,选用K3[Fe(CN)6]溶液证明Fe2+已全部被氧化的实验现象为________________________________________________。
(4)“除铁”时,可选用Na2CO3为除铁剂,其原理为____________________________。
(5)已知Ge(OH)4,具有两性,在得到Ge(OH)4的过程中,若溶液的pH大于12,会导致Ge(OH)4溶解,写出该反应的离子方程式:________________________________。
(6)利用惰性电极电解酸性GeSO4溶液也可制得GeO2,则阳极的电极反应式为___________________。
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
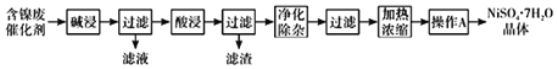
现用含镍废催化剂制备NiSO47H2O晶体,其流程图如下:
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为______。
(2)“酸浸”所使用的酸为______。
(3)“净化除杂”需加入H2O2溶液,其作用是______。然后调节pH使溶液中铁元素恰好完全沉淀,列式计算此时的pH。______
(4)“操作A”为______、过滤、洗涤、干燥,即得产品。
(5)NiSO4在强碱性溶液中可被NaClO氧化为NiOOH,该反应的离子方程式为______。
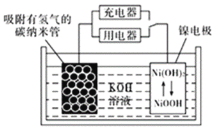
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如图所示,其放电时,正极的电极反应式为______。
【题目】菱锰矿的主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素。氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①相关金属离子[c0(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
②常温下,CaF2、MgF2的溶度积常数分别为1.46×10-10、 7.42×10-11
回答下列问题:
(1) “焙烧”时发生的主要反应的化学方程式为__________。气体X为________(填化学式),写出它生活中的一种用途_______________。
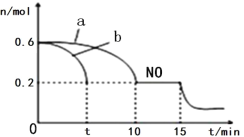
(2)焙烧时温度对锰浸出率的影响如图所示。焙烧时适应温度为_______________。

(3)浸出液“净化除杂”过程如下:首先用MnO2将Fe2+氧化为Fe3+,再调节溶液的pH将Al3+、Fe3+变成沉淀除去,溶液的pH的范围为____然后加入NH4F将Ca2+、Mg2+转化为CaF2、MgF2沉淀除去,两种沉淀共存时,溶液中![]() =________(所得结果保留两位小数)。
=________(所得结果保留两位小数)。
(4)碳化结晶的原理(用离子方程式表示): ______________________。
(5)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为_________。
(6)在该工艺流程中可以循环使用的物质有__________。(填化学式)
【题目】锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:

已知氢氧化锶在水中的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=____。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时的氧化产物为___(填化学式);再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是__。