题目内容
【题目】写出木炭与浓硫酸反应的化学方程式____。
为了验证产物中的二氧化碳气体,甲、乙两同学分别设计如下实验(已知Br2+2H2O+SO2=H2SO4+2HBr):
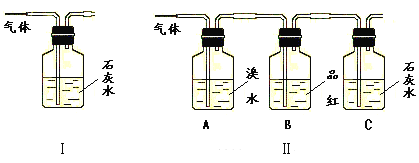
请回答下列问题:
(1)能否根据Ⅰ装置中石灰水变浑浊的现象说明产物中一定有二氧化碳气体?___,理由是____。
(2)Ⅱ装置中A的作用是___;B的作用是___。
(3)根据B中品红__,C中产生___,说明产物中一定有二氧化碳气体。
【答案】C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 不能 因为SO2与石灰水反应生成CaSO3也难溶于水 除去SO2 检验SO2是否已除净 不褪色 浑浊(或白色沉淀)
CO2↑+2SO2↑+2H2O 不能 因为SO2与石灰水反应生成CaSO3也难溶于水 除去SO2 检验SO2是否已除净 不褪色 浑浊(或白色沉淀)
【解析】
根据木炭与浓硫酸发生的反应书写化学方程式;检验SO2和CO2混合气体中的二氧化碳,应排除二氧化硫的干扰,用氧化剂可把二氧化硫氧化,同时用品红溶液检验是否除尽,这样石灰水变浑浊才能说明有CO2,据此分析作答。
木炭与浓硫酸反应会生成二氧化硫、二氧化碳和水,其化学方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;故答案为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(1)因SO2和CO2都能使石灰水变浑浊,因此要想检验出CO2,应先除掉SO2,这样石灰水变浑浊才能说明有CO2;答案为:不能;因为SO2与石灰水反应生成CaSO3也难溶于水;
(2)因SO2和CO2都能使石灰水变浑浊,因此要想检验出CO2,应先除掉SO2,根据二氧化硫具有还原性,可用溴水把二氧化硫吸收,反应方程式为:Br2+SO2+2H2O=2HBr+2H2SO4,可根据二氧化硫能使品红褪色来检验二氧化硫是否除尽;
故答案为:除去SO2;检验SO2是否已除净;
(3)要检验二氧化碳,应证明无二氧化硫,现象为B中品红不褪色;根据二氧化碳与澄清石灰水变浑浊来检验二氧化碳,反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O,现象为C中产生浑浊,故答案为:不褪色;浑浊(或白色沉淀)。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】(1)下列物质中属于强电解质的是______,属于弱电解质的是______,属于非电解质的是_____。(填字母)
A.铜丝 B. AgI C. 稀盐酸 D. 干冰 E. 氨水 F. 次氯酸 G. Ba(OH)2·8H2O H. Fe(OH)2 I. 蔗糖
(2)结合表中给出的电离平衡常数回答下列问题:
酸 | CH3COOH | HNO2 | HCN | HClO |
电离平衡常数(Ka) | 1.8×10-5 | 4.6×10-4 | 5×10-10 | 3×10-8 |
①上述四种酸中,酸性最弱、最强的酸分别是_______、_______(用化学式表示)。
②下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是__________(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式___________________________________。
【题目】现有四组分散系:①汽油和水形成的混合液②含有泥沙的食盐水③溶有碘(I2)的氯化钾溶液④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见表)。
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 |
乙二醇 | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
请用如图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )

A. ①—c—分液B. ②—a—萃取
C. ③—c—萃取D. ④—a—蒸馏

