��Ŀ����
����Ŀ���ʻ���COS�Ľṹ��CO2���ƣ��㷺��������úΪԭ�ϵĸ��ֻ���ԭ�����У�����������ж�����ѧ��Ʒ�����½��ʹ�����Ⱦ���ʻ������ⷴӦ��ˮ�ⷴӦ�����ֳ��õ��������䷴Ӧʽ�ֱ�Ϊ��
����ⷴӦ��COS(g)+H2(g) ![]() H2S(g)+ CO(g) ��H=+7 kJ/mol
H2S(g)+ CO(g) ��H=+7 kJ/mol
��ˮ�ⷴӦ�� COS(g)+H2O(g) ![]() H2S(g)+ CO2(g) ��H = ?
H2S(g)+ CO2(g) ��H = ?
��֪��Ӧ����صĻ�ѧ�������������£�

�ش��������⣺
��1���ʻ���ĽṹʽΪ��___________��
��2����֪�Ȼ�ѧ����ʽCO(g)+H2O(g) ![]() H2(g)+ CO2(g) ��H3 ����H3 =__________kJ/mol��
H2(g)+ CO2(g) ��H3 ����H3 =__________kJ/mol��
��3��COS����ⷴӦ��ƽ�ⳣ��K���¶�T�������µĹ�ϵʽ ![]() ��ʽ��a��b��Ϊ������
��ʽ��a��b��Ϊ������
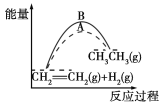
����ͼ�У���ʾCOS��ⷴӦ��ֱ��Ϊ__________��


��һ�������£�����A��B��COS����ⷴӦ�����д����ã�������������ʾ��
��a1____a2 (����>������<������=��)��
��ij�¶��£����������������У���COS��H2����ʼ�����Ϊ1��V��ƽ���COS��H2�������Ϊ1��10V������¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K=_________��������V�ı���ʽ��
��1��COS��ȫȼ�ջ����ɴ�����Ⱦ��SO2��Ŀǰ����ѧ�������о�һ������ϩ��Ϊ��ԭ��������SO2�������������������ͼ2�����������¶ȡ������ʣ�����ɸ�д����������������Ĺ�ϵ��ͼ3��

�ٸ�����ԭ���ܷ�Ӧ�Ļ�ѧ����ʽΪ_________________________________________;
�ھ�ͼ3��Ϊ�ﵽ�������Ч����Ӧ��ȡ�ľ��巴Ӧ������________________________;
�۸���a������450�����ϵı仯���ƣ��������ܵ�ԭ���ǣ�______________________��
��5��Ϊ�ⶨij�����̵�����SO2�ĺ������ֽ�16.00 L�̵�������ͨ��1.00 Lˮ����SO2��ȫ�����գ�����Һ������䡣ȡ��20.00 mL��Һ����1.18��10-3mol��L-1�ı��͵�ˮ��֮��Ӧ����ǡ����ȫ��Ӧʱ���ĵ�ˮ19.07 mL����ó��̵�����SO2�ĺ���Ϊ________________mg��L-1��
���𰸡� O=C=S -42 z = K= ![]() C2H4 +2O2+SO2 = S+ 2CO2 + 2H2O��2C2H4 +3O2+ 2SO2 = 2S+ 4CO2 + 4H2O��C2H4 +O2+2SO2 = 2S+ 2CO2 + 2H2O ������Ϊ3.0%���¶�Ϊ350�� ���������´���ʧ�� 4.5
C2H4 +2O2+SO2 = S+ 2CO2 + 2H2O��2C2H4 +3O2+ 2SO2 = 2S+ 4CO2 + 4H2O��C2H4 +O2+2SO2 = 2S+ 2CO2 + 2H2O ������Ϊ3.0%���¶�Ϊ350�� ���������´���ʧ�� 4.5
�����������������(1)����CO2�Ľṹʽ��дCOS�Ľṹʽ����2�����ݷ�Ӧ����ܼ��ܣ���������ܼ���=�ʱ�������CO(g)+H2O(g) ![]() H2(g)+ CO2(g)���ʱ䣻(3)��������ѧ����ʽ
H2(g)+ CO2(g)���ʱ䣻(3)��������ѧ����ʽ![]() ��ʽ��a��b��Ϊ�������������������ƽ�ⳣ�����䣻������������ʽ������COS(g)+H2(g)
��ʽ��a��b��Ϊ�������������������ƽ�ⳣ�����䣻������������ʽ������COS(g)+H2(g) ![]() H2S(g)+ CO(g)��Ӧ��ƽ�ⳣ����(4) ������ͼʾ������������������ϩ��Ӧ����������̼��ˮ���ھ�ͼ3��������Ϊ3.0%���¶�Ϊ350�� ʱ��������ߣ��۸���a������450�����ϣ������ʽ��ͣ��������ܵ�ԭ���Ǹ��������´���ʧ������5��SO2��ȫ�����������������������ᱻ�ⵥ������Ϊ���ᣬ���ݹ�ϵʽ�����������ĺ�����
H2S(g)+ CO(g)��Ӧ��ƽ�ⳣ����(4) ������ͼʾ������������������ϩ��Ӧ����������̼��ˮ���ھ�ͼ3��������Ϊ3.0%���¶�Ϊ350�� ʱ��������ߣ��۸���a������450�����ϣ������ʽ��ͣ��������ܵ�ԭ���Ǹ��������´���ʧ������5��SO2��ȫ�����������������������ᱻ�ⵥ������Ϊ���ᣬ���ݹ�ϵʽ�����������ĺ�����
������(1) ������̼�Ľṹʽ��O=C=O���ʻ���COS�Ľṹ��CO2���ƣ�����COS�Ľṹʽ��O=C=S��
��2���٣�COS(g)+H2(g) ![]() H2S(g)+ CO(g) ��H=+7 kJ/mol
H2S(g)+ CO(g) ��H=+7 kJ/mol
��CO(g)+H2O(g) ![]() H2(g)+ CO2(g) ��H3
H2(g)+ CO2(g) ��H3
���ݸ�˹���ɢ٣��ڵ�COS(g)+H2O(g) ![]() H2S(g)+ CO2(g)����H=��H3+7 kJ/mol�����ݷ�Ӧ����ܼ��ܣ���������ܼ���=�ʱ�����H=��H3+7 kJ/mol=742+577+465��2��339��2��803��2=-35 kJ/mol��������H3= -42 kJ/mol��(3)��������ѧ����ʽ
H2S(g)+ CO2(g)����H=��H3+7 kJ/mol�����ݷ�Ӧ����ܼ��ܣ���������ܼ���=�ʱ�����H=��H3+7 kJ/mol=742+577+465��2��339��2��803��2=-35 kJ/mol��������H3= -42 kJ/mol��(3)��������ѧ����ʽ![]() ��ʽ��a��b��Ϊ��������
��ʽ��a��b��Ϊ��������![]() ������
������ ![]() ��С����ѡC���� �������ƽ�ⳣ������������a1=a2��
��С����ѡC���� �������ƽ�ⳣ������������a1=a2��
�� ��COS��H2����ʼͶ�Ϸֱ�Ϊ1��V����Ӧ��ת��Ϊx��
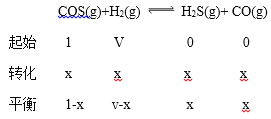
��������(1-x)��(v-x)=1:10v
![]()
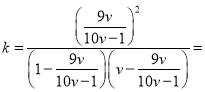
![]() ��
��
(4) ������ͼʾ������������������ϩ��Ӧ����������̼��ˮ������ʽ��C2H4 +2O2+SO2 = S+ 2CO2 + 2H2O���ھ�ͼ3��������Ϊ3.0%���¶�Ϊ350�� ʱ��������������۸���a������450�����ϣ������ʽ��ͣ��������ܵ�ԭ���Ǹ��������´���ʧ������5��SO2��ȫ���������������ᣬ����ʽ��H2O+SO2=H2SO3�������ᱻ�ⵥ������Ϊ���ᣬ����ʽ��H2SO3+ I2+H20=H2SO4+2HI�����ݹ�ϵʽSO2![]() I2
I2
![]() =
= ![]() ��
�� ![]() �� ���ó��̵�����SO2�ĺ���Ϊ
�� ���ó��̵�����SO2�ĺ���Ϊ![]() 4.5mg/L��
4.5mg/L��

 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�����Ŀ��H2O2��һ�ֳ����Լ�����ʵ���ҡ���ҵ�������й㷺��;

��.ʵ������H2O2������������ֽ������ܶ�������Ӱ�졣ʵ����70��ʱ��ͬ������H2O2Ũ����ʱ��ı仯����ұ�����ͼ��ʾ��
��1������˵����ȷ���ǣ�________������ĸ��ţ�
A��ͼ�ױ���������������ͬʱ��H2O2Ũ��ԽС����ֽ�����Խ��
B��ͼ�ұ���������������ͬʱ����Һ����Խ����H2O2�ֽ�����Խ��
C��ͼ������������Mn 2+����ʱ����Һ����Խǿ��H2O2�ֽ�����Խ��
D��ͼ����ͼ��������������Һ�У�Mn2+��H2O2�ֽ����ʵ�Ӱ���
��2������Mn2+�ڷ�Ӧ�У��ı���____________________(����ĸ���)
A����Ӧ���� B����Ӧ��C����Ӧ�ʱ� D����Ӧ·��
E.��Ӧ��� F.����Ӱٷ���
��. H2O2�ڹ�ҵ����ΪFenton����Ҫ�Լ��������ڴ������ѽ����л���Ĺ�ҵ��ˮ���ڵ��ں�pH����Һ������ԣ���Fe2+Ũ�ȵķ�ˮ�м���H2O2�����������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p-CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�졣
��ʵ����ơ�����p-CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K������ʵ���������±�����������¶Ա����飬����ʵ��������ʱ��-p-CPŨ��ͼ���¡�

��3�������Ե��ǻ����ɻ��ĵ���ʽΪ��______________
��4�����������ʵ����Ʊ�(���в�Ҫ���ո�)��
ʵ�� ��� | ʵ��Ŀ�� | T/K | pH | c/10-3mol��L-1 | |
H2O2 | Fe2+ | ||||
�� | Ϊ����ʵ�����ο� | 298 | 3 | 6.0 | 0.30 |
�� | ̽���¶ȶԽ��ⷴӦ���ʵ�Ӱ�� | _________ | ______ | _______ | _________ |
�� | __________________ | 298 | 10 | 6.0 | 0.30 |
��5�����������ͼʵ�������ߣ����㽵�ⷴӦ��50��150s�ڵķ�Ӧ���ʣ�v(p-CP)=_____________
��6��ʵ��ʱ���ڲ�ͬʱ��ӷ�Ӧ����ȡ������ʹ��ȡ��Ʒ�еķ�Ӧ����ֹͣ����������ʵ����������һ��Ѹ��ֹͣ��Ӧ�ķ�����__________________________��