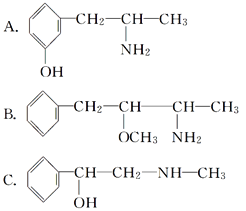
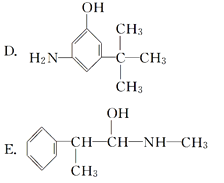
��Ŀ����
����Ŀ����﮵�ص����С�������������dz��õ�һ�ε�ء��õ�ط�Ӧԭ����ͼ��ʾ�����е����LiClO4���ڻ���л��ܼ��У�Li+ͨ�������Ǩ����MnO2�����У�����LiMnO2���ش��������⣺
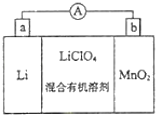
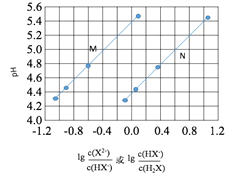
��1�����·�ĵ���������______(����a��b������b��a��)��
��2�����������Ӧʽ_______��
��3��������ˮ�������еĻ���л��ܼ���ԭ����________��
��4��MnO2����KOH��KClO3�ڸ����·�Ӧ������K2MnO4����Ӧ�Ļ�ѧ����ʽΪ_____��K2MnO4��������Һ���绯������KMnO4��MnO2�����ʵ���֮��Ϊ_____��
���𰸡�b��a MnO2+e��+Li+=LiMnO2 �缫Li�ǻ��ý���������ˮ��Ӧ 3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O 2��1
3K2MnO4+KCl+3H2O 2��1
��������
�γ�ԭ��ط�Ӧʱ��LiΪ���������������缫��ӦʽΪLi-e-=Li+��MnO2Ϊ����������ԭ���缫����ʽΪMnO2+e-+Li+=LiMnO2���ݴ˷������
(1)LiΪ������MnO2Ϊ������ԭ��ع���ʱ�����·�ĵ����������������ߵ�����������b������a�����ʴ�Ϊ��b��a��
(2)MnO2Ϊ����������ԭ���缫��ӦʽΪMnO2+e-+Li+=LiMnO2���ʴ�Ϊ��MnO2+e-+Li+=LiMnO2��
(3)������ΪLi������ˮ��Ӧ��������ˮ�������еĻ���л��ܼ����ʴ�Ϊ���缫Li�ǻ��ý���������ˮ��Ӧ��
(4)MnO2����KOH��KClO3�ڸ����·�Ӧ������K2MnO4����Ӧ�Ļ�ѧ����ʽΪ3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O��K2MnO4��������Һ���绯������KMnO4��MnO2����Ӧ��MnԪ�ػ��ϼ���+6�����ߵ�+7�ۡ���+6�۽��͵�+4�ۣ���������ԭ��Ӧ�������ͻ�ԭ��֮���ʧ������Ŀ��ȿ�֪������KMnO4��MnO2�����ʵ���֮��Ϊ2��1���ʴ�Ϊ��3MnO2+KClO3+6KOH
3K2MnO4+KCl+3H2O��K2MnO4��������Һ���绯������KMnO4��MnO2����Ӧ��MnԪ�ػ��ϼ���+6�����ߵ�+7�ۡ���+6�۽��͵�+4�ۣ���������ԭ��Ӧ�������ͻ�ԭ��֮���ʧ������Ŀ��ȿ�֪������KMnO4��MnO2�����ʵ���֮��Ϊ2��1���ʴ�Ϊ��3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O��2��1��
3K2MnO4+KCl+3H2O��2��1��

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�