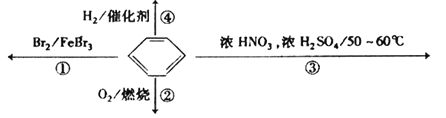
题目内容
【题目】将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是
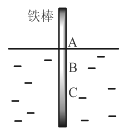
A.铁棒AB段发生反应为O2+ 4e-+ 2H2O = 4OH-
B.腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段
C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响
D.产生这种现象的本质原因是铁棒所处的化学环境不同
【答案】C
【解析】
AB段产生较多铁锈,BC段腐蚀严重,这说明构成的原电池中AB段是正极,BC段是负极。
A.铁棒AB段是正极,氧气得到电子,发生反应为O2+ 4e-+ 2H2O = 4OH-,A正确;
B.腐蚀过程中构成原电池,电流从正极流向负极,则在铁棒上会产生微电流,且方向是AB段到BC段,B正确;
C.向水中加入一定量硫酸钾固体后,电解质溶液的浓度增大,加快铁棒的生锈速率,C错误;
D.根据已知信息和以上分析可知产生这种现象的本质原因是铁棒所处的化学环境不同,D正确;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】双氧水(H2O2)和水都是极弱电解质,但H2O2溶液显酸性
(1)若把H2O2看成二元弱酸。请写出其在水中的电离方程式:_________。
(2)二氧化锰是实验室制取氧气的催化剂。下列是某同学设计实验探究双氧水分解实验方案:
实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
Ⅰ | 5% | 0.2g | 20°C | |
Ⅱ | 5% | 0.5g | 20°C | |
Ⅲ | 10% | 0.2g | 20°C |

①利用实验Ⅰ和Ⅲ,探究________对化学反应速率的影响,实验待测数据是_________:若在本组实验中现象不明显,可采取的措施是_________________。
(3)加0.1 mol MnO2,粉末于50mL过氧化氢溶液(H2O2,ρ=1.1 gmL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。

①前4min内氧气的产生速率为________mLmin-1
②A、B、C、D各点反应速率由快到慢的顺序为_____________。
③解释反应速率变化的原因_________________。
④计算H2O2初始状态的浓度______________。