题目内容
【题目】双氧水(H2O2)和水都是极弱电解质,但H2O2溶液显酸性
(1)若把H2O2看成二元弱酸。请写出其在水中的电离方程式:_________。
(2)二氧化锰是实验室制取氧气的催化剂。下列是某同学设计实验探究双氧水分解实验方案:
实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
Ⅰ | 5% | 0.2g | 20°C | |
Ⅱ | 5% | 0.5g | 20°C | |
Ⅲ | 10% | 0.2g | 20°C |

①利用实验Ⅰ和Ⅲ,探究________对化学反应速率的影响,实验待测数据是_________:若在本组实验中现象不明显,可采取的措施是_________________。
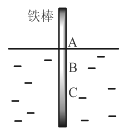
(3)加0.1 mol MnO2,粉末于50mL过氧化氢溶液(H2O2,ρ=1.1 gmL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。

①前4min内氧气的产生速率为________mLmin-1
②A、B、C、D各点反应速率由快到慢的顺序为_____________。
③解释反应速率变化的原因_________________。
④计算H2O2初始状态的浓度______________。
【答案】H2O2 H++HO2-、HO2- H++O22- 浓度 收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积);升高到相同的温度 将三个实验升高到相同的温度; 15mL/min D>C>B>A 刚开始时受温度和浓度两方面的影响,速率较快,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小 0.107 molL1
【解析】
(1)过氧化氢是弱电解质,属于二元弱酸分步电离;
(2)①根据控制单一变量法,比较实验Ⅰ和Ⅲ的数据可知,两个实验中二氧化锰的质量和实验温度都是相同的,只有双氧水溶液的浓度不同,则探究的是浓度对化学反应速率的影响;可以通过测定收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积)来比较反应速率的快慢;若在本组实验中现象不明显,可采取的措施是升高到相同的温度;
(3)①前4min内生成60mL氧气,根据速率单位可知,该速率用单位时间内的体积变化来表示;
②反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小;
③2H2O2 ![]() 2H2O+O2↑反应为放热反应,刚开始时受温度和浓度两方面的影响,速率较快,但由于随着反应进行,反应物的浓度逐渐减小,速率逐渐减小,综合温度和浓度两方面的影响,浓度变化更大,所以速率逐渐减小;
2H2O+O2↑反应为放热反应,刚开始时受温度和浓度两方面的影响,速率较快,但由于随着反应进行,反应物的浓度逐渐减小,速率逐渐减小,综合温度和浓度两方面的影响,浓度变化更大,所以速率逐渐减小;
④2H2O2 ![]() 2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,则可列比例式计算n(H2O2),进而计算其浓度。
2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,则可列比例式计算n(H2O2),进而计算其浓度。
(1)过氧化氢是弱电解质,H2O2溶液显酸性,属于二元弱酸,分步电离,电离的方程式为:H2O2 H++HO2-、HO2- H++O22-;
故答案为:H2O2 H++HO2-、HO2- H++O22-;
(2)①比较实验Ⅰ和Ⅲ的数据可知,两个实验中二氧化锰的质量和实验温度都是相同的,只有双氧水溶液的浓度不同,则探究的是浓度对化学反应速率的影响,可以通过测定收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积)来比较反应速率的快慢;若在本组实验中现象不明显,可采取的措施是将三个实验升高到相同的温度;
故答案为:浓度;收集等体积氧气所需要的时间(或者相同时间内收集氧气的体积);将三个实验升高到相同的温度;
(3)①前4min内生成60mL氧气,则氧气的产生速率为![]() ;
;
故答案为:15mL/min;
②反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小;
故答案为:D>C>B>A;
③2H2O2 ![]() 2H2O+O2↑反应为放热反应,刚开始时受温度和浓度两方面的影响,速率较快,但由于随着反应进行,反应物的浓度逐渐减小,速率逐渐减小,综合温度和浓度两方面的影响,浓度变化更大(减小的较多),所以速率逐渐减小;,
2H2O+O2↑反应为放热反应,刚开始时受温度和浓度两方面的影响,速率较快,但由于随着反应进行,反应物的浓度逐渐减小,速率逐渐减小,综合温度和浓度两方面的影响,浓度变化更大(减小的较多),所以速率逐渐减小;,
故答案为:刚开始时受温度和浓度两方面的影响,速率较快,随着反应的进行,双氧水的浓度逐渐减小,反应速率也逐渐减小;
④2H2O2 ![]() 2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,则可列比例式:
2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,则可列比例式:
2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
2mol 22.4L
n(H2O2) 0.06L![]() ,解得:n(H2O2)=0.00536mol,所以
,解得:n(H2O2)=0.00536mol,所以![]() ;
;
故答案为:0.107 molL1。

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案【题目】将一定量的SO2(g)和O2(g)置于一恒容密闭容器中,在不同温度下进行反应(已知该反应为放热反应)。实验记录得到下表中的两组数据:下列有关说法中不正确的是( )
实验序号 | 温度(℃) | 平衡常数(L/mol) | 起始量/mol | 平衡量/mol | 达到平衡所需时间(min) | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. 表中x=1.6;y=0.2B. 表中t>6
C. 表中K1、K2的关系:K2>K1D. 实验1在前6min的反应速率υ(SO2)=0.2mol/(Lmin)