题目内容
【题目】下列指定反应的离子方程式正确的是
A. 澄清石灰水中通入过量二氧化碳:OH-+CO2=HCO3-
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. 漂白粉溶液吸收少量二氧化硫气体:SO2+H2O+ClO- = SO42-+Cl-+2H+
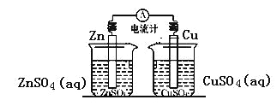
D. 下图所示装置中反应:Zn+Cu2+= Cu + Zn2+
【答案】A
【解析】
A. 澄清石灰水中通入过量二氧化碳生成碳酸氢钙;
B. 离子反应需注意电荷守恒;
C. 次氯酸为弱酸,在离子方程式中不能拆写;
D.未形成闭合回路,不会发生原电池反应。
A.澄清石灰水中通入二氧化碳先生成碳酸钙沉淀后,过量后沉淀溶解为碳酸氢钙溶液,碳酸氢钙要拆写为钙离子与碳酸氢根离子,故反应前后变化为:OH-+CO2=HCO3-,A正确;
B.反应式中电荷不守恒,未配平,应为5I +IO3+6H+![]() 3I2+3H2O,B不正确;
3I2+3H2O,B不正确;
C.漂白粉溶液吸收少量二氧化硫气体,而漂白粉过量,溶液中还有大量ClO,则不会有大量的H+生成,应生成次氯酸分子:SO2+H2O+3ClO- =SO42-+Cl-+2HClO,C不正确;
D.图示装置未形成闭合回路,并未形成原电池,故写成原电池反应Zn+Cu2+= Cu+Zn2+,D不正确。故选A。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】已知下列元素的原子半径:
元素 | N | S | O | Si |
原子半径/1010 m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷元素的原子半径可能是
A. 0.80×1010 m B. 1.10×1010 m
C. 1.20×1010 m D. 0.70×1010 m
【题目】根据下列实验方案所得到的现象,得出的结论一定正确的是
甲中玻璃管盛放的物质 | 乙中现象 | 结论 | |
A | 还原铁粉、用水湿润的玻璃纤维 | 肥皂水中有气泡 | 水蒸气高温下与铁反应生成了氢气 |
B | CaCO3 、SiO2 | 石灰水变浑浊 | CaCO3 和 SiO2 高温下反应生成了 CO2 |
C | 碎瓷片、石蜡油(主要成分为烷烃) | 酸性 KMnO4 溶液褪色 | 石蜡油可能发生了分解反应 |
D | FeCl3 固体(熔点 306℃、沸点 315℃)、MnO2 固体 | 淀粉 KI 溶液变蓝 | 加热时 MnO2 能将 FeCl3 氧化成 Cl2 |
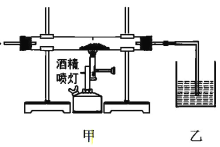
A. A B. B C. C D. D