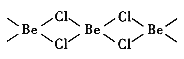
��Ŀ����
����Ŀ����ҵ������������Ҫ�ɷ�Ϊ����������FeTiO3��������MgO��SiO2�����ʣ�Ϊԭ�ϣ��Ʊ������Ѻ�����Ĺ����������£�

��֪������ʱ��FeTiO3ת��ΪFe2+��TiO2+
��1��FeTiO3��TiԪ�صĻ��ϼ�Ϊ_____�ۣ��������;Ϊ____________����дһ�֣���
��2�� ��ˮ�����У�������Ӧ�����ӷ���ʽΪ______________________________��
��3�� ���������У����ɵ�������̬����ĵ���ʽΪ______________���ù��̿��Ʒ�Ӧ�¶ȵ���35����ԭ��Ϊ_______________________________________��
��4��FeCO3ת��Ϊ����ʱ�������Ļ�ѧ����ʽΪ_______________________________��
��5���Ƶõ�FeCO3�ɼ���������ϡ���ᣬ�����Һ�л���̷��IJ�����_____________��
��6�����������ʱ��TiO2 ��ʯī���缫�������Ϊ���ڵ�CaO���������ķ�ӦʽΪ_______��
���𰸡�+4 ����ɫ�����Ϳ�ϡ�ұ���� ![]()
![]() ��ֹ̼����立ֽ�
��ֹ̼����立ֽ�  ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ���� TiO2+4e-=Ti+2O2-
����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ���� TiO2+4e-=Ti+2O2-
��������
��������������Һ�ܽ⣬����FeTiO3+2H2SO4�TFeSO4+TiOSO4+2H2O��MgO+H2SO4�TMgSO4+H2O�����˷��������1ΪSiO2����Һ�к���TiOSO4��FeSO4��δ��Ӧ������ȣ�ˮ������H2TiO3�����պ�������������Ti����Һ2����Fe2+��Mg2+����̼�������Һ�����������ӣ�����̼������������������������Һ3��þ���ӣ���Һ3�������Ʊ�Mg(OH)2��Qc��Kspʱ���ɳ������Դ������
(1)FeTiO3��TiԪ�صĻ��ϼ�Ϊ0-(+2)-(-2)��3=+4�ۡ��������;Ϊ�Ʊ���ɫ���Ϻ����ᡢұ�����ȣ�
(2)��ˮ�����У�������Ӧ�����ӷ���ʽΪ![]() ����
����![]() ����
����
(3)���������У���̬����ĵ���ʽΪ![]() ���ù�������Ʒ�Ӧ�¶ȵ���35�棬ԭ��Ϊ��ֹNH4HCO3�ֽ�(�����Fe2+��ˮ��)��
���ù�������Ʒ�Ӧ�¶ȵ���35�棬ԭ��Ϊ��ֹNH4HCO3�ֽ�(�����Fe2+��ˮ��)��
(4)FeCO3ת��Ϊ����ʱ��������Ӧ�Ļ�ѧ����ʽΪ ��
��
(5)FeCO3����������ϡ����õ�FeSO4��Һ���ٽ�����Һ��������Ũ������ȴ�ᾧ�����ˡ�ϴ��(����)�Ȳ������ɻ���̷����壻
(6)���ʱ������������ԭ��Ӧ����Ti���缫����ʽΪTiO2+4e-=Ti+2O2-��

 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�����Ŀ��ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬���������Ը�����������ķ�Ӧ����¼����ʵ�����ݣ�
ʵ���� | ʵ���¶� | �Թ��������Լ��������� / mL | ��Һ������ɫ����ʱ��/ min | |||
0.6mol/L H2C2O4 ��Һ | H2O | 3mol/L H2SO4 ϡ��Һ | 0.05mol/L KMnO4��Һ | |||
�� | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
�� | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
�� | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
��1����д���÷�Ӧ�����ӷ���ʽ__________________________________________,���÷�Ӧ�Ա������ݷ�Ӧ��ȫʱת�Ƶ�����Ϊ_______________NA
��2��V1 ______
��3�������ϱ��е�ʵ����������������Եõ��Ľ�����_____��
��4��̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ����Ӧѡ��_____����ʵ���ţ�
��5����С��ͬѧ���ݾ�������� n ��Mn 2+ ����ʱ��仯��������ͼ 1 ��ʾ������ͬѧ�������е�ʵ�����Ϸ�������ʵ������� n ��Mn 2+ �� ��ʱ��仯��ʵ��������ͼ 2 ��ʾ��
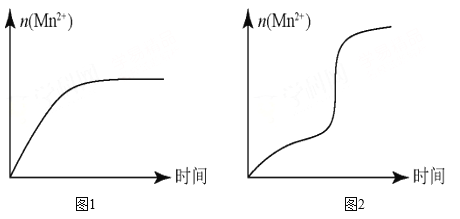
��С��ͬѧ����ͼ 2 ��ʾ��Ϣ������µļ��������������ʵ�鷽����������ʵ��̽����
ʵ���� | ʵ���¶�/�� | �Թ��������Լ��������� | �ټ���ij�ֹ��� | ��Һ������ɫ����ʱ�� / min | |||
�� | 25 | 0.6mol/L H2C2O4 ��Һ | H2O | 3mol/L H2SO4 ϡ��Һ | 0.05mol/L KMnO4 ��Һ | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
�ٸ�С��ͬѧ����ļ�����_____��
������С��ͬѧ����ļ��������Ӧ�۲쵽_________________________________����