题目内容
【题目】铍及其化合物的应用正日益被重视。
(l)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为______________________________。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.都能与氢氧化钠溶液反应
(3)铍、镁晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点比镁的熔点高,原因是_____________________________________________________。
(4)氯化铍在气态时存在BeC12分子(a)和二聚分子(BeCl2)2(b),固态时则具有如图所示的链状结构(c)。

①a属于_____“极性”或“非极性”)分子。
②b中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为________(标出配位键)。
③c中Be原子的杂化方式为_____。
④氯化铍晶体中存在的作用力有_____(填标号)。
A.范德华力 B.σ键 C.极性键 D.非极性键 E.离子键
(5)BeO立方晶胞如图所示。

①BeO晶体中,O2﹣的配位数为_____。
②若BeO晶体的密度为dg/cm3,BeO的摩尔质量为Mg·mol-1,阿伏伽德罗常数为NA,则晶胞参数a=_______________ cm (列出计算式即可)。
【答案】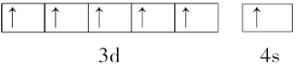 BD Be原子半径比Mg原子半径小,金属键更强 非极性
BD Be原子半径比Mg原子半径小,金属键更强 非极性 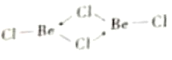 sp3 ABC 4
sp3 ABC 4 ![]()
【解析】
Cr为24号元素,基态Cr原子价电子为3d54s1,其轨道表示式为![]() 。
。
(2);镁铝同一周期,原子序数逐渐增大,所以铝的电负性比镁大。A.铝属于p区主族元素,铍属于s区元素,故A错误;B.铍和铝的性质相似,电负性都比镁大,故B正确;C.铍和镁在同一主族,半径逐渐增大,所以第一电离能都比镁大,铝和镁在同一周期,则铝的第一电离能比镁小,故C错误;D.铍和铝为主族的元素,都在金属和非金属的分界线处,及表现金属性质有表现非金属性质,所以都能和氢氧化钠溶液反应,故D正确。
3)铍、镁在同一主族,都是由金属原子密置层在三维空间堆积而成,铍的原子半径比Mg原子半径小,金属键更强,所以铍的熔点比镁的熔点高。答案:铍原子半径比Mg原子半径小,金属键更强。
(4)①BeC12是直线形分子,正负电荷中心重合,为非极性分子.因此,本题正确答案是:非极性.
②b为BeC12的二聚体(BeC12)2,且所有原子都在平面上,Be中含有空轨道,Cl含有孤电子对,可形成配位键,b的结构式应为:![]() .因此,本题正确答案是:
.因此,本题正确答案是:![]() 。
。
③c为BeC12的长链状分子,一个Be与4个Cl成键,故为sp3杂化.因此,本题正确答案是: sp3。
④氯化铍晶体与AlC13相似, AlC13为共价化合物,则BeC12也为共价化合物,均为分子晶体,分子间为范德华力, BeC12中Be-C1为![]() 键,且Be和Cl电负性不同,为极性键,而分子为非极性分子,所以含有的是ABC.因此,本题正确答案是: ABC。
键,且Be和Cl电负性不同,为极性键,而分子为非极性分子,所以含有的是ABC.因此,本题正确答案是: ABC。
(5))①根据晶胞图,BeO晶体中,O2-周围等径的有4个Be2+,与金刚石晶胞相似,O连接4个Be形成一个四面体,因此O的配位数为4.因此,本题正确答案是:4。
②立方晶胞中,顶点占1/8,面心占1/2,棱上占1/4,内部为整个晶胞所有,则一个BeO晶胞中,含有Be2+数目为8![]() =4,O2-的数目为4,取1mol晶胞,则有NA个晶胞,1mol晶胞的质量为m=4Mg,一个晶胞体积为V0=a3nm3 ,所以1mol晶胞密度为,所以a=
=4,O2-的数目为4,取1mol晶胞,则有NA个晶胞,1mol晶胞的质量为m=4Mg,一个晶胞体积为V0=a3nm3 ,所以1mol晶胞密度为,所以a=![]() 因此,本题正确答案是:
因此,本题正确答案是:![]() 。
。

 阅读快车系列答案
阅读快车系列答案





