题目内容
11. 某无色溶液,可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现各取两份100mL溶液进行如下实验:
某无色溶液,可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现各取两份100mL溶液进行如下实验:①第一份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为9.32g.
②第二份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
已知:2Al3++2CO32-+3H2O=2Al(OH)3↓+3CO2↑
(1)由此推断,原溶液一定含有的阳离子种类及其浓度,将结果填入下表(可不填满).
| 一定含有的阳离子种类 | ||||||
| 物质的量浓度(mol/L) |
分析 根据无色溶液可知,有颜色的离子不能存在,一定不含Cu2+;
①第一份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为9.32g,说明溶液中CO32-和SO42-至少有一种;
③第二份逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀质量不变,则溶液中一定含NH4+;后继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+和Mg2+;由于Al3+和CO32-会发生双水解而不共存,所以溶液中一定不含CO32-,则一定含有SO42-;
根据溶液中的电荷守恒以及离子的检验方法进行解答.
解答 解:根据无色溶液可知,有颜色的离子不能存在,一定不含Cu2+;
①第一份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为9.32g,说明溶液中CO32-和SO42-至少有一种;
③第二份逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3•H2O,说明含有铵根离子,最后沉淀不能完全溶液,说明溶液中含Mg2+,由于Al3+和CO32-会发生双水解而不共存,所以溶液中一定不含CO32-,则一定含有SO42-,则生成的9.32g沉淀为BaSO4.
第一份加足量BaCl2溶液后,有白色沉淀产生,此沉淀为BaSO4,经洗涤、干燥后,沉淀质量为9.32g,则溶液中n(SO42-)=$\frac{9.32g}{233g/mol}$=0.04mol.
(1)当加入40mLNaOH溶液时,剩余的沉淀是Mg(OH)2,n(Mg(OH)2)=0.01mol,根据原子守恒知,n(Mg2+)=0.01mol,c(Mg2+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,生成0.01molMg(OH)2需要n(NaOH)是0.02mol,Al(OH)3和NaOH反应生成NaAlO2需要NaOH溶液的体积是5mL,则铝离子和NaOH溶液反应生成Al(OH)3沉淀时需要NaOH溶液的体积是15mL,则生成氢氧化镁需要NaOH溶液的体积是10mL,所以c(NaOH)=$\frac{0.02mol}{0.01L}$=2.00mol/L,氢氧化铝和NaOH溶液反应生成NaAlO2时,结合原子守恒知,c(Al3+)=$\frac{2mol/L×0.005L}{0.1L}$=0.1mol/L,c(NH4+)=$\frac{2mol/L×0.01L}{0.1L}$=0.2mol/L,溶液中c(SO42-)=$\frac{0.04mol}{0.1L}$=0.4mol/L,
根据溶液中电荷守恒知,3c(Al3+)+c(NH4+)+2(Mg2+)<2c(SO42-),所以溶液中还存在K+,还可能含有NO3-,且根据电荷守恒可知,溶液中的c(K+)≥0.1mol/L.
故答案为:
| 一定含有的离子种类 | Mg2+ | NH4+ | Al3+ | K+ |
| 物质的量浓度(mol/L) | 0.1 | 0.2 | 0.1 | ≥0.1 |
(2)通过分析可知,溶液中一定不含H+、Cu2+、CO32-,一定含NH4+、K+、Mg2+、Al3+、SO42-,可能含NO3-,故无法确定的是NO3-;NO3-在酸性环境下有强氧化性,加入铜粉等还原性物质会发生氧化还原反应,生成无色的NO气体,在空气中会变为红棕色,故答案为:NO3-,用小试管取少量溶液,加入少量浓硫酸,再向试管中加入铜屑并加热,产生的气体在空气中变成红棕色证明含有硝酸根离子.
点评 本题考查了离子共存、离子反应的计算等知识点,定性分析离子共存、定量分析离子的物质的量是解本题的关键,题目难度大.

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | 铁能被磁铁吸引,且纯铁比生铁更易生锈 | |
| B. | 向煤中加入适量石灰石,可大大减少燃烧产物中SO2的量 | |
| C. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 维生素C能帮助人体将食物中摄取的Fe3+转化为Fe2+,因为维生素具有还原性 |
| A. | O2:二氧化锰和双氧水 带火星的木条 | |
| B. | Cl2:二氧化锰和浓盐酸 品红溶液 | |
| C. | CO2:大理石和稀硫酸 澄清石灰水 | |
| D. | NH3:NH4Cl固体和NaOH固体 湿润的红色石蕊试纸 |
| A. | 相同体积,不同密度的N2和CO两种气体 | |
| B. | 相同密度的O2和O3两种气体 | |
| C. | 相同质量,不同密度的C2H4和C3H8两种气体 | |
| D. | 相同物质的量,不同体积的NH3和CH4两种气体 |

| A. | 图1装置可制取、收集干燥纯净的NH3 | |
| B. | 图2装置可以完成“喷泉”实验 | |
| C. | 图3装置可测量Cu 与浓硝酸反应产生气体的体积 | |
| D. | 图4装置可用比较NaHCO3和Na2CO3的热稳定性 |
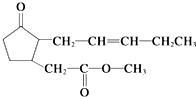 茉莉酸甲酯具有强烈而持久的茉莉花香,广泛用于人工配制的茉莉精油中,其结构简式如图所示.下列关于茉莉酸甲酯的说法中不正确的是( )
茉莉酸甲酯具有强烈而持久的茉莉花香,广泛用于人工配制的茉莉精油中,其结构简式如图所示.下列关于茉莉酸甲酯的说法中不正确的是( )| A. | 分子式为C13H20O3 | B. | 茉莉酸甲酯易溶于水 | ||
| C. | 能使酸性KMnO4溶液褪色 | D. | 能使Br2的CCl4溶液褪色 |
| A. | 蔗糖溶液加入稀硫酸共热后,加入银氨溶液,水浴加热,检验水解产物具有还原性 | |
| B. | 在气体发生装置上直接点燃甲烷时,必须先检验甲烷的纯度 | |
| C. | 不慎将苯酚溶液沾到皮肤上,要立即用强碱溶液冲洗 | |
| D. | 为提纯蛋白质,可向鸡蛋清溶液中加入醋酸铅溶液,然后将所得沉淀滤出重新溶于水,即得较纯的蛋白质溶液 |
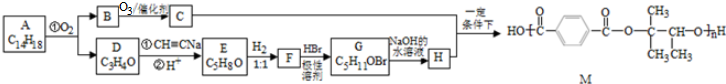
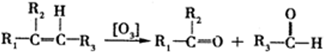
 ,D的化学名称是丙酮.
,D的化学名称是丙酮.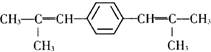 .
. .
.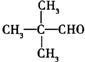 (填结构简式).
(填结构简式).