题目内容
【题目】甲烷、氧气、KOH 溶液可构成燃料电池提供电能。按要求填写:
(1)该电池总反应的离子方程式为___________________________。
(2)通入甲烷的电极为原电池的________极,该电极反应式为:______________________。
(3)电池工作时,正极区域溶液的pH__________(填“增大、减小或不变”)。
(4) 电路中通过3mol 电子转移时,消耗的氧气体积为(标况)_____________________。
【答案】 CH4+2O2+2OH-=![]() +3H2O CH4-8e-+10OH-=
+3H2O CH4-8e-+10OH-=![]() +7H2O O2+2H2O+4e-
+7H2O O2+2H2O+4e-![]() 4OH- 增大 16.8L
4OH- 增大 16.8L
【解析】本题主要考查原电池原理。
(1)该电池反应的离子方程式为CH4+2O2+2OH-=![]() +3H2O。
+3H2O。
(2)通入甲烷的电极为原电池的负极,该电极反应式为:CH4-8e-+10OH-=![]() +7H2O。
+7H2O。
(3)电池工作时,正极反应为O2+2H2O+4e-![]() 4OH-,正极区域溶液的pH增大。
4OH-,正极区域溶液的pH增大。
(4)电路中通过3mol电子转移时,消耗的氧气0.75mol,体积为(标况)16.8L。

 阅读快车系列答案
阅读快车系列答案【题目】I、乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图的装置制备乙酸乙酯。
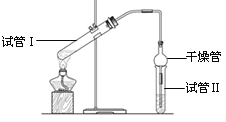
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:_____________。
(2)请写出用CH3CH218OH制备乙酸乙酯的化学方程式:_____________,反应类型为_______。
(3)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验 编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中的试剂 | 有机层的厚度/cm |
A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1 。
②分析实验_________________(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(4)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________(用百分数表示,保留一位小数)。
II、已知乳酸的结构简式为![]() 。试回答:
。试回答:
①乳酸分子中的官能团有:_____________________________________(写名称);
②乳酸与足量金属钠反应的化学方程式为________________________________;
③已知—COOH不会发生催化氧化,写出加热时,乳酸在Cu作用下与O2反应的化学方程式:________________________________________________;
④腈纶织物产泛地用作衣物、床上用品等。腈纶是由CH2=CH-CN聚合而成的。 写出在催化剂、加热条件下制备腈纶的化学方程式________________________。