题目内容
【题目】I、乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图的装置制备乙酸乙酯。
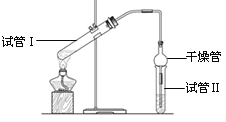
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:_____________。
(2)请写出用CH3CH218OH制备乙酸乙酯的化学方程式:_____________,反应类型为_______。
(3)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验 编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中的试剂 | 有机层的厚度/cm |
A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1 。
②分析实验_________________(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(4)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________(用百分数表示,保留一位小数)。
II、已知乳酸的结构简式为![]() 。试回答:
。试回答:
①乳酸分子中的官能团有:_____________________________________(写名称);
②乳酸与足量金属钠反应的化学方程式为________________________________;
③已知—COOH不会发生催化氧化,写出加热时,乳酸在Cu作用下与O2反应的化学方程式:________________________________________________;
④腈纶织物产泛地用作衣物、床上用品等。腈纶是由CH2=CH-CN聚合而成的。 写出在催化剂、加热条件下制备腈纶的化学方程式________________________。
【答案】防止倒吸CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O酯化反应34A C60.6%羟基、羧基
CH3CO18OCH2CH3+H2O酯化反应34A C60.6%羟基、羧基 2CH3CHOHCOOH+O2
2CH3CHOHCOOH+O2![]() 2CH3COCOOH+2H2O
2CH3COCOOH+2H2O
【解析】
(1)乙酸、乙醇易溶于碳酸钠溶液,会导致装置内气体减小,容易发生倒吸,球形干燥管容积较大,故可以防止倒吸,故答案为:防止倒吸;(2)根据酯化反应的机理可知反应方程式:CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O,反应类型为取代反应或酯化反应;(3)①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,由于在实验C中使用的硫酸是3mL2mol/L,所以在实验D中应加入一元强酸盐酸的体积和浓度分别是3mL和4mol/L;②分析实验A、C 可知:其它条件相同只有硫酸的浓度不同,而最终使用浓硫酸反应产生的酯多,说明浓H2SO4的吸水性提高了乙酸乙酯的产率;故答案为AC;(4)n(乙酸)=90g÷60g/mol=1.5mol,n(乙醇)=138g÷46g/mol=3mol,由于乙醇过量,所以应该按照乙酸来计算得到的酯的质量。n(乙酸乙酯)=80÷88g/mol=0.909mol,则该反应的产率为0.909 mol÷1.5mol×100%=60.6%;II.①乳酸分子中的官能团有羟基和羧基,故答案为羟基、羧基;②乳酸分子中的羟基氢和羧基氢都能被金属钠置换,故反应方程式为
CH3CO18OCH2CH3+H2O,反应类型为取代反应或酯化反应;(3)①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,由于在实验C中使用的硫酸是3mL2mol/L,所以在实验D中应加入一元强酸盐酸的体积和浓度分别是3mL和4mol/L;②分析实验A、C 可知:其它条件相同只有硫酸的浓度不同,而最终使用浓硫酸反应产生的酯多,说明浓H2SO4的吸水性提高了乙酸乙酯的产率;故答案为AC;(4)n(乙酸)=90g÷60g/mol=1.5mol,n(乙醇)=138g÷46g/mol=3mol,由于乙醇过量,所以应该按照乙酸来计算得到的酯的质量。n(乙酸乙酯)=80÷88g/mol=0.909mol,则该反应的产率为0.909 mol÷1.5mol×100%=60.6%;II.①乳酸分子中的官能团有羟基和羧基,故答案为羟基、羧基;②乳酸分子中的羟基氢和羧基氢都能被金属钠置换,故反应方程式为![]() ,③加热时,乳酸在Cu作用下与O2反应主要的羟基被催化氧化,故反应方程式为2CH3CHOHCOOH+O2
,③加热时,乳酸在Cu作用下与O2反应主要的羟基被催化氧化,故反应方程式为2CH3CHOHCOOH+O2![]() 2CH3COCOOH+2H2O;④ 腈纶是由丙烯腈发生加聚反应而得到的,反应的方程式为
2CH3COCOOH+2H2O;④ 腈纶是由丙烯腈发生加聚反应而得到的,反应的方程式为![]() 。
。

【题目】如图1是某同学在实验室中进行铝热反应(铝过量)的实验装置,实验中他观察到的现象之一为“纸漏斗的下部被烧穿,有熔融物落入沙中”。

(1)写出该反应的化学方程式:________________________________________________。
(2)为检验铝热反应后的固体成分,请填写下表:
检验成分 | 操作步骤 | 实验现象与结论 |
铝 | ____________ | ___________ |
氧化铁 | _____________ | ____________ |
(3)探究铝热反应后固体的性质:将反应后容器中的固体残余置于烧杯中,加入一定量稀硝酸,固体完全溶解,反应过程中无气体放出(活泼金属可把稀HNO3)还原为NH4NO3)。在反应后的溶液中缓慢滴加4 mol·L-1的NaOH溶液,产生沉淀的物质的量(mol)与加入NaOH溶液的体积(ml)的关系如图2所示:
①1写出DE段发生反应的离子方程式:_____________________________________________。
②B与A的差值为_______________________________________________________________。