题目内容
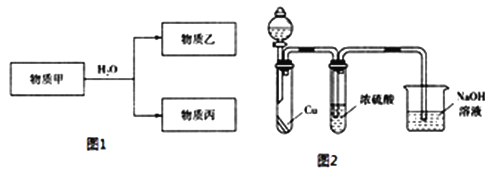
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为:LaCl3+6NH4HCO3= La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。

(1)盛放稀盐酸的仪器为__________________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→ → → → → 。_____________
(3)Y中发生反应的化学反应式为____________________________________。
(4)X中盛放的试剂是____________,其作用为___________________________。
(5)Z中应先通入NH3,后通入过量的CO2,原因为_________________________。
(6)La2(CO3)3质量分数的测定:准确称取10.0g产品试样,溶于10.0mL稀盐酸中,加入10 mL NH3-NH4Cl缓冲溶液,加入0.2 g紫脲酸铵混合指示剂,用0.5 mol·L-1 EDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La 3++H2Y2-= LaY-+2H+),消耗EDTA溶液44.0 mL。则产品中La2(CO3)3的质量分数w[La2(CO3)3]=________________。
(7)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为__________;实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示。在t1 min之后固体质量增加的原因可能是_______________。


【答案】 分液漏斗 F→A→B→D→E→C NH3·H2O+CaO= Ca(OH)2+NH3↑ NaHCO3溶液 吸收挥发的HCl同时产生CO2 NH3在水的溶解度大 50.38% La(HCO3)3 La2O3被空气中的氧气氧化成更高价态的氧化物
【解析】(1)W中盛放稀盐酸的仪器为分液漏斗。(2)由装置可知,W中制备二氧化碳,X除去HCl,Y中制备氨气,在Z中制备碳酸镧,则制备碳酸镧实验流程中导管从左向右的连接顺序为:F→A→B→D→E→C。(3)Y中发生反应的化学反应式为NH3·H2O+CaO= Ca(OH)2+NH3↑。(4)X中盛放的试剂是 NaHCO3溶液,其作用为吸收挥发的HCl同时产生CO2。(5)Z中应先通入NH3,后通入过量的CO2,原因为NH3在水中溶解度大,二氧化碳在水中溶解度不大,碱性溶液利于吸收二氧化碳。(6)由方程式La 3++H2Y2-= LaY-+2H+得:n(La 3+)=n(EDTA)=44.0 mL×0.5 mol·L-1 =2.2×10-2mol,所以n(La2(CO3)3)=2.2×10-2mol/2=1.1×10-2mol,m(La2(CO3)3)=1.1×10-2mol×458g·mol-1=5.038g产品中La2(CO3)3的质量分数w[La2(CO3)3]=5.038g/10.0g=0.5038,即5038%。(7)一般正盐的稳定性强于酸式盐,所以探究La2(CO3)3和La(HCO3)3的稳定性强弱,可以给正盐更高的温度条件下加热,甲试管中盛放的物质为La(HCO3)3;实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线,在t1 min之后固体质量增加的原因可能是La2O3被空气中的氧气氧化成更高价态的氧化物。

 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案