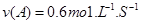题目内容
(11分)已知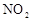 和
和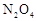 可以相互转化:
可以相互转化: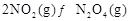 △H<0。现将一定量
△H<0。现将一定量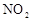 和
和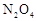 的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
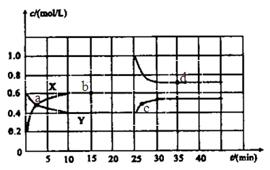
(1)图中共有两条曲线X和Y,其中曲线________表示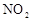 浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收
浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收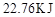 的热量,则该反应的热化学方程式为__________。
的热量,则该反应的热化学方程式为__________。
(2)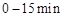 ,反应
,反应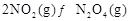 的平衡常数K(b)=__________;比较
的平衡常数K(b)=__________;比较 在
在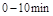 时平均反应速率
时平均反应速率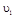 与
与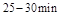 时平均反应速率
时平均反应速率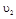 的大小__________。
的大小__________。
(3)反应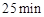 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
(4)若要达到使 的体积百分含量与d点相同的化学平衡状态,在
的体积百分含量与d点相同的化学平衡状态,在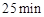 时还可以采取的措施是___________。
时还可以采取的措施是___________。
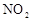 和
和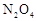 可以相互转化:
可以相互转化: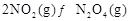 △H<0。现将一定量
△H<0。现将一定量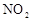 和
和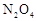 的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
(1)图中共有两条曲线X和Y,其中曲线________表示
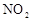 浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收
浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收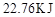 的热量,则该反应的热化学方程式为__________。
的热量,则该反应的热化学方程式为__________。(2)
 ,反应
,反应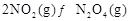 的平衡常数K(b)=__________;比较
的平衡常数K(b)=__________;比较 在
在 时平均反应速率
时平均反应速率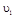 与
与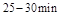 时平均反应速率
时平均反应速率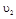 的大小__________。
的大小__________。(3)反应
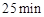 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。(4)若要达到使
 的体积百分含量与d点相同的化学平衡状态,在
的体积百分含量与d点相同的化学平衡状态,在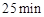 时还可以采取的措施是___________。
时还可以采取的措施是___________。| A.加入催化剂 | B.缩小容器体积 | C.升高温度 | D.加入一定量的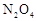 |
(11分)(1)X(1分) 2NO2 N2O4 △H=-56.9KJ/mol(2分)
N2O4 △H=-56.9KJ/mol(2分)
(2)K ,
, (各2分)(3)增大
(各2分)(3)增大 的浓度 =(各1分)(4)BD(2分)
的浓度 =(各1分)(4)BD(2分)
 N2O4 △H=-56.9KJ/mol(2分)
N2O4 △H=-56.9KJ/mol(2分)(2)K
 ,
, (各2分)(3)增大
(各2分)(3)增大 的浓度 =(各1分)(4)BD(2分)
的浓度 =(各1分)(4)BD(2分)(1)根据图像可知,曲线X的浓度变化量是曲线Y的浓度变化量的2倍,所以根据方程式可知,X曲线表示NO2的浓度随时间的变化。根据图像可知,N2O4的浓度减少了0.6mol/L-0.4mol/L=0.2mol/L,物质的量是0.4mol,所以消耗1molN2O4的反应热是22.76kJ÷0.4mol=56.9kJ/mol,因此热化学方程式是2NO2 N2O4 △H=-56.9KJ/mol。
N2O4 △H=-56.9KJ/mol。
(2)根据图像可知,10min反应达到平衡,N2O4和NO2的浓度分别是0.4mol/L、0.6mol/L,所以反应的平衡常数是 。根据图像可知,0~10min内N2O4的反应速率是0.2mol/L÷10min=0.02mol/(L·min),在25~30min内N2O4的反应速率是0.15mol/L÷5min=0.03mol/(L·min),所以
。根据图像可知,0~10min内N2O4的反应速率是0.2mol/L÷10min=0.02mol/(L·min),在25~30min内N2O4的反应速率是0.15mol/L÷5min=0.03mol/(L·min),所以 。
。
(3)根据图像可知,25min时NO2的浓度突然增大,而N2O4的浓度逐渐增大,所以改变的体积是增大了NO2的浓度;温度不变,所以平衡常数不变。
(4)催化剂不能改变平衡状态,A不正确;缩小容器容积,压强增大,平衡向正反应方向移动;升高温度,平衡向逆反应方向进行;加入一定量的N2O4,相当于增大压强,平衡向正反应方向进行,所以正确的答案选BD。
 N2O4 △H=-56.9KJ/mol。
N2O4 △H=-56.9KJ/mol。(2)根据图像可知,10min反应达到平衡,N2O4和NO2的浓度分别是0.4mol/L、0.6mol/L,所以反应的平衡常数是
 。根据图像可知,0~10min内N2O4的反应速率是0.2mol/L÷10min=0.02mol/(L·min),在25~30min内N2O4的反应速率是0.15mol/L÷5min=0.03mol/(L·min),所以
。根据图像可知,0~10min内N2O4的反应速率是0.2mol/L÷10min=0.02mol/(L·min),在25~30min内N2O4的反应速率是0.15mol/L÷5min=0.03mol/(L·min),所以 。
。(3)根据图像可知,25min时NO2的浓度突然增大,而N2O4的浓度逐渐增大,所以改变的体积是增大了NO2的浓度;温度不变,所以平衡常数不变。
(4)催化剂不能改变平衡状态,A不正确;缩小容器容积,压强增大,平衡向正反应方向移动;升高温度,平衡向逆反应方向进行;加入一定量的N2O4,相当于增大压强,平衡向正反应方向进行,所以正确的答案选BD。

练习册系列答案
相关题目
 pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍。下列说法中正确的是( )
pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍。下列说法中正确的是( ) B + C在某一温度时,达到平衡。
B + C在某一温度时,达到平衡。 ?CO2(g)+H2(g)达平衡后,得到0.6 mol CO2;再通入0.3 mol水蒸气,达到新平衡状态后,CO2的物质的量可能是( )
?CO2(g)+H2(g)达平衡后,得到0.6 mol CO2;再通入0.3 mol水蒸气,达到新平衡状态后,CO2的物质的量可能是( ) pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。
pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又知平均反应速率v(C)=2v(B)。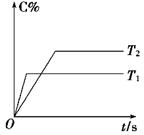
 2SO3,下列叙述正确的是( )
2SO3,下列叙述正确的是( ) 2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1 、
、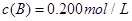 及
及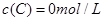 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。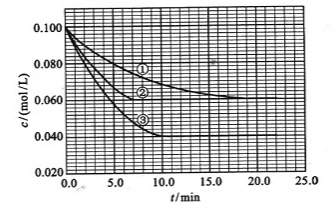
 _________0,判断其理由是__________________________________;
_________0,判断其理由是__________________________________;