题目内容
某温度下,反应2A(g) B(g)+C(g)的平衡常数为1,在溶积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表
下列说法正确的是
A.反应前20s的平均速率为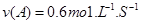
B.20s时,正反应速率等于逆反应速率
C.达平衡时,A(g)的转化率为100%
D.若升高温度,平衡常数将变为0.5,则反应的△H<0
| 物质 | A(g) | B(g) | C(g) |
| 物质的量/mo1 | 1.2 | 0.6 | 0.6 |
A.反应前20s的平均速率为
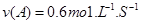
B.20s时,正反应速率等于逆反应速率
C.达平衡时,A(g)的转化率为100%
D.若升高温度,平衡常数将变为0.5,则反应的△H<0
D
根据方程式可知,20s内消耗A是1.2mol,所以A的反应速率是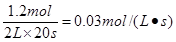 ,A不正确;20s时,ABC的浓度分别是(mol/L)0.6、0.3、0.3,所以此时
,A不正确;20s时,ABC的浓度分别是(mol/L)0.6、0.3、0.3,所以此时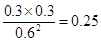 <1,因此平衡向正反应方向移动,C不正确;可逆反应的转化率不可能是100%,所以选项C不正确。升高温度,平衡常数减小,说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,D正确,答案选D。
<1,因此平衡向正反应方向移动,C不正确;可逆反应的转化率不可能是100%,所以选项C不正确。升高温度,平衡常数减小,说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,D正确,答案选D。
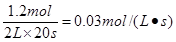 ,A不正确;20s时,ABC的浓度分别是(mol/L)0.6、0.3、0.3,所以此时
,A不正确;20s时,ABC的浓度分别是(mol/L)0.6、0.3、0.3,所以此时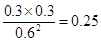 <1,因此平衡向正反应方向移动,C不正确;可逆反应的转化率不可能是100%,所以选项C不正确。升高温度,平衡常数减小,说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,D正确,答案选D。
<1,因此平衡向正反应方向移动,C不正确;可逆反应的转化率不可能是100%,所以选项C不正确。升高温度,平衡常数减小,说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,D正确,答案选D。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
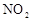 和
和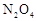 可以相互转化:
可以相互转化: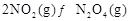 △H<0。现将一定量
△H<0。现将一定量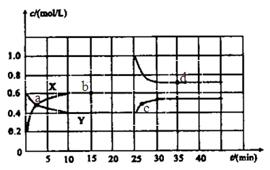
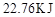 的热量,则该反应的热化学方程式为__________。
的热量,则该反应的热化学方程式为__________。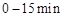 ,反应
,反应 在
在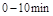 时平均反应速率
时平均反应速率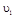 与
与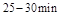 时平均反应速率
时平均反应速率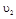 的大小__________。
的大小__________。 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。 的体积百分含量与d点相同的化学平衡状态,在
的体积百分含量与d点相同的化学平衡状态,在 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )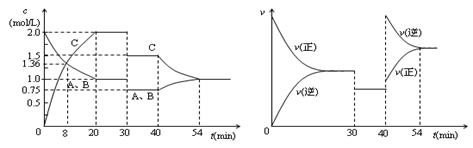
 x C(g);ΔH<0
x C(g);ΔH<0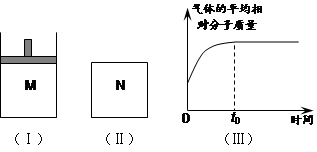
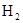 在443K~473K温度下钴作催化剂,可生成碳原子数为5~8的烷烃.在390℃,300个大气压下,利用水煤气为原料,可以合成甲醇:
在443K~473K温度下钴作催化剂,可生成碳原子数为5~8的烷烃.在390℃,300个大气压下,利用水煤气为原料,可以合成甲醇: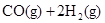

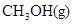 .当CO和
.当CO和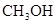 的体积分数,试推导出m,a,y之间的关系式.
的体积分数,试推导出m,a,y之间的关系式.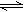 2Z(g)达到平衡时有50%的Y转化为气体Z,若X的转化率为25%,则起始时充入容器的X与Y的物质的量之比应为( )
2Z(g)达到平衡时有50%的Y转化为气体Z,若X的转化率为25%,则起始时充入容器的X与Y的物质的量之比应为( ) CO2(气)+NO(气)△H<0,达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(气)+NO(气)△H<0,达到平衡后,只改变其中一个条件,对平衡的影响是: 3C(g)+D(g),达到平衡时C的浓度为W mol·L-1。若维持容器体积和温度不变,按下列四种方法改变起始物质及其量,达到平衡后C的浓度仍为W mol·L-1的是( )
3C(g)+D(g),达到平衡时C的浓度为W mol·L-1。若维持容器体积和温度不变,按下列四种方法改变起始物质及其量,达到平衡后C的浓度仍为W mol·L-1的是( )