题目内容
6.聚丙烯酸酯的结构为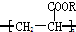 ,下列有关它的说法中,不正确的是( )
,下列有关它的说法中,不正确的是( )| A. | 它可由CH2=CH-COOR经加成聚合反应得到 | |
| B. | 在一定条件下能发生加成反应 | |
| C. | 聚丙烯酸酯材料是一种混合物 | |
| D. | 聚丙烯酸酯是高分子化合物 |
分析 该物质中只含酯基,具有酯的性质,
A.将两个半键连接即得其单体;
B.该物质中不含不饱和键或苯环,不能发生加成反应;
C.n值不同其分子式不同;
D.相对分子质量在10000以上的化合物为高分子化合物.
解答 解:该物质中只含酯基,具有酯的性质,
A.将两个半键连接即得其单体,其单体为CH2=CH-COOR,所以它可由CH2=CH-COOR经加成聚合反应得到,故A正确;
B.该物质中不含不饱和键或苯环,不能发生加成反应,故B错误;
C.n值不同其分子式不同,所以该物质是混合物,故C正确;
D.相对分子质量在10000以上的化合物为高分子化合物,n很大,所以属于高分子化合物,故D正确;
故选B.
点评 本题考查有机物结构和性质,侧重考查学生分析判断能力,明确物质中存在的官能团是解本题关键,易错选项是C.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
16.用丙醛制取1,2-丙二醇,其合成路线依次发生的反应类型为( )
| A. | 还原→取代→加成→消去 | B. | 氧化→加成→取代→消去 | ||
| C. | 消去→加聚→取代→还原 | D. | 还原→消去→加成→取代 |
17.下列说法正确的是( )
| A. | 最外层有2个电子的元素都是金属元素 | |
| B. | 不管哪一个电子层作为最外层,其电子数都不能超过8个 | |
| C. | 在原子核外的电子层中,电子层大的能量低,电子层小的能量高 | |
| D. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
1.下列对能量转化的认识中,不正确的是( )
| A. | 电解水生成氢气和氧气时,电能主要转化为化学能 | |
| B. | 风力发电时,风能主要转化为电能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 白炽灯工作时,电能全部转化为光能 |
11.下列各组物质气化或熔化时,所克服的微粒间的作用力,属同种类型的是( )
| A. | 氯化钠和铁的熔化 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 碘和干冰的升华 | D. | 食盐和冰的熔化 |
18.把a,b,c三块金属片浸入稀硫酸中,用导线两两相连组成原电池,若a,b相连时,a为负数;b,c相连时,电子由c经导线流向b;a,c相连时,c极上产生大量气泡,则三种金属的活动性由强到弱的顺序为( )
| A. | a>b>c | B. | a>c>b | C. | c>a>b | D. | c>b>a |
16.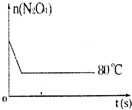 在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4?2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4?2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20s-40s内用N2O4表示的平均反应速率为0.002mol/(L•s).
(2)80℃该反应的平衡常数K=1.8mol•L-1.
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有(填序号)D,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)AB.
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线.
 在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4?2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4?2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)80℃该反应的平衡常数K=1.8mol•L-1.
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有(填序号)D,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)AB.
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线.
 ;
;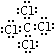 ,分子内含有极性键.
,分子内含有极性键.