题目内容
【题目】按下面各个小题的要求填空
(1)有下列各组物质,将符合下方描述的组合对应的字母填在横线上
A.O2和O3 B.12C和13C C.甲烷和庚烷D.CH3CH2CH2CH3和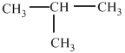 E.
E. 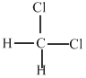 和
和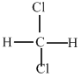
a.____________组两物质互为同位素。
b.____________组两物质互为同素异形体。
c.____________组两物质属于同系物。
d. ____________组两物质互为同分异构体。
(2)(1)①P4(s,白磷)+5O2(g)=P4O10(s) △H1=2983.2kJ/mol
②P(s,红磷)+5/4O2(g)=1/4P4O10(s),△H=738.5kJ/mol
根据上述信息,写出白磷转化为红磷的热化学方程式________.
(3)已知C2H4(g)和C2H5OH(l)的燃烧热分别是1141kJ/mol和1366.8kJ/mol,写出C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式:_______。
(4)某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜。某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下气体6.72L(其中NO2和NO的体积比为2:1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比___________。
②反应后得到的溶液中H+的浓度为1.0mol/L,求原硝酸的物质的量浓度。(假设反应前后溶液的体积不变)_____________
【答案】B A C D P4(白磷,s)=4P(红磷,s) ΔH=-29.2kJ/mol C2H4(g)+H2O(l)=C2H5OH(l) ΔH=-44.2kJ/mol 5:2 11mol/L
【解析】
(1)根据同系物、同分异构体、同位素、同素异形体的定义分析判断;
(2)根据盖斯定律可以计算化学反应的焓变,进而书写热化学方程式;
(3)根据燃烧热写出热化学方程式,再利用盖斯定律来计算C2H4(g)和H2O(l)反应生成C2H5OH(l)的反应热,以此来书写热化学方程式;
(4)①根据气体的体积计算出气体的物质的量,进而计算NO2和NO的物质的量,再求出转移的电子,最后根据得失电子守恒计算出n(Cu),进而确定n(CuO);②反应后溶液中存在硝酸、硝酸铜,结合N原子守恒计算。
(1)A、氧气和臭氧是氧元素的不同单质,是同素异形体;B、12C和13C都是碳元素的不同原子,是同位素;C、甲烷和庚烷是结构相似,在分子组成上相差若干个CH2原子团,互称同系物;D、丁烷和2-甲基丙烷的分子式相同,但结构不同,是同分异构体;E、二氯甲烷为四面体结构,所以二氯甲烷只有一种,故两物质是同一物质;故答案为:B;A;C;D;
(2)①P4(s,白磷)+5O2(g)=P4O10(s),△H1=-2983.2kJ/mol ,②P(s,红磷)+![]() O2(g)=
O2(g)=![]() P4O10(s),△H=-738.5kJ/mol,根据盖斯定律,①-②×4得到热化学方程式为:P4(s,白磷)=4P(s,红磷) △H=-2983.2kJ/mol-(-738.5×4)kJmol-1=-29.2kJ/mol,故答案为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;
P4O10(s),△H=-738.5kJ/mol,根据盖斯定律,①-②×4得到热化学方程式为:P4(s,白磷)=4P(s,红磷) △H=-2983.2kJ/mol-(-738.5×4)kJmol-1=-29.2kJ/mol,故答案为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;
(3)25℃、101kPa下,C2H4(g)和C2H5OH(l)的燃烧热分别是1411.0kJmol-1和1366.8kJmol-1,则①C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411.0kJmol-1,②C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJmol-1,由盖斯定律可知,①-②可得反应C2H4(g)+H2O(l)=C2H5OH(l) △H=-1411.0kJmol-1-(-1366.8kJmol-1)=-44.2 kJmol-1,故答案为:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2 kJmol-1;
(4)①标准状况下的气体6.72L的物质的量=![]() =0.3mol,其中NO2和NO的体积比为2∶1,则n(NO)=0.1mol,n(NO2)=0.2mol,则硝酸得到的电子物质的量为0.1mol×(5-2)+0.2mol×(5-4)=0.5mol,由得失电子守恒可知n(Cu)=
=0.3mol,其中NO2和NO的体积比为2∶1,则n(NO)=0.1mol,n(NO2)=0.2mol,则硝酸得到的电子物质的量为0.1mol×(5-2)+0.2mol×(5-4)=0.5mol,由得失电子守恒可知n(Cu)=![]() =0.25mol,则n(CuO)=
=0.25mol,则n(CuO)=![]() =0.1mol,则废铜屑中铜和氧化铜的物质的量之比为0.25mol∶0.1mol=5∶2,故答案为:5∶2;
=0.1mol,则废铜屑中铜和氧化铜的物质的量之比为0.25mol∶0.1mol=5∶2,故答案为:5∶2;
②若反应后的溶液中H+的浓度为1molL-1,则溶液中存在硝酸、硝酸铜,由N原子守恒可知原硝酸溶液中n(HNO3)=n(H+)+2n[Cu(NO3)2]+n(NO2)+n(NO) =0.1L×1mol/L+2×0.35mol+0.1mol+0.2mol=1.1mol,则原硝酸的物质的量浓度为![]() =11molL-1,故答案为:11molL-1。
=11molL-1,故答案为:11molL-1。

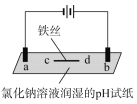
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜