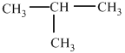
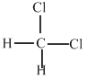
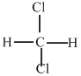
题目内容
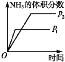
【题目】某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g)cC(g) △H=QkJmol1(Q>0),12s时生成C的物质的量为0.8mol(反应进程如图所示)。下列说法中正确的是( )
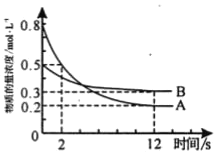
A. 图中交点时A的消耗速率等于A的生成速率
B. 0-2s内,用A表示的反应速率为0.15molL1s1
C. 化学计量数之比b∶c=1∶4
D. 12s内,反应放出0.2Q kJ热量
【答案】B
【解析】
某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)cC(g)△H=-Q kJmol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol。
A.交点时,随时间变化A的浓度变化,反应未达到平衡状态,A的消耗速率不等于A的生成速率,故A错误;
B.根据图像可知,0-2s内,A的浓度变化=0.8mol/L-0.5mol/L=0.3mol/L,反应速率v=![]() =
=![]() =0.15mol/(Ls),故B正确;
=0.15mol/(Ls),故B正确;
C.根据图象可知,12s时反应达到平衡,A的浓度变化=0.8mol/L-0.2mol/L=0.6mol/L,A表示的反应速率=![]() =0.05mol/(Ls),B的浓度变化=0.5mol/L-0.3mol/L=0.2mol/L, B表示的反应速率=
=0.05mol/(Ls),B的浓度变化=0.5mol/L-0.3mol/L=0.2mol/L, B表示的反应速率=![]() =
=![]() mol/(Ls),C表示的反应速率=
mol/(Ls),C表示的反应速率= =
=![]() mol/(Ls),速率之比等于化学方程式计量数之比,3∶b∶c=0.05∶
mol/(Ls),速率之比等于化学方程式计量数之比,3∶b∶c=0.05∶![]() ∶
∶![]() ,解得:b=1,c=2,化学计量数之比b∶c=1∶2,故C错误;
,解得:b=1,c=2,化学计量数之比b∶c=1∶2,故C错误;
D.12s内反应A的物质的量=(0.8mol/L-0.2mol/L)×2L=1.2mol,结合3A(g)+B (g)2C(g)△H=-Q kJmol-1,1.2molA反应放出热量0.4QkJ,故D错误;
故选B。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A. AB. BC. CD. D