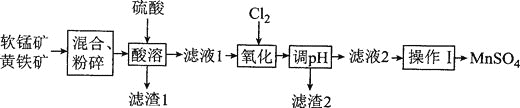
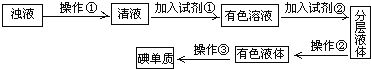
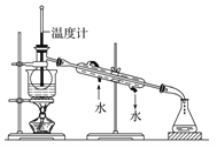
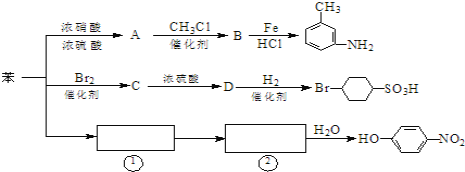
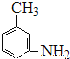
题目内容
【题目】工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因_____。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为_____。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)![]() Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
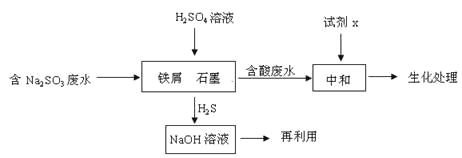
①中和含酸废水工业常用的试剂x是_____。
②写出H2S气体与足量NaOH溶液反应的化学方程式____。
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:____。
④已知:2H2S(g)+O2(g) =2S(s) +2H2O(l) △H=-632.8kJ/mol
SO2 (g) =S(s)+ O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为_____。
【答案】S2-+ H2O![]() HS-+ OH- 1:2 > 石灰水 H2S + 2NaOH = Na2S + 2H2O SO32-+ 8H+ + 6e-= H2S↑+ 3H2O 2H2S(g)+3O2(g) = 2SO2 (g) + 2H2O(l) △H= -1172.4kJ/mol
HS-+ OH- 1:2 > 石灰水 H2S + 2NaOH = Na2S + 2H2O SO32-+ 8H+ + 6e-= H2S↑+ 3H2O 2H2S(g)+3O2(g) = 2SO2 (g) + 2H2O(l) △H= -1172.4kJ/mol
【解析】
(1)某制革厂含硫废水中主要含有的物质是Na2S,
①Na2S属于强碱弱酸盐,S2-水解使溶液呈碱性,水解的离子方程式表示为:S2-+ H2O![]() HS-+ OH-;
HS-+ OH-;
②1molNa2S转化为1molNa2SO4,失去8mol电子,而1molO2被还原,得到4mol电子,根据得失电子守恒,还原剂与氧化剂的物质的量之比为1:2;温度升高平衡常数增大,说明升高温度平衡向正反应移动,则正反应吸热,即△H>0;
(2)①中和含酸废水工业常用廉价的石灰水;
②H2S气体与足量NaOH溶液反应生成Na2S和水,反应的化学方程式为H2S+2NaOH=Na2S+2H2O;
③SO32-在酸性条件下放电生成H2S的过程为得电子的还原反应,电极反应式为SO32-+8H++6e-=H2S↑+3H2O;
④已知:①2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol,
②SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol,
利用盖斯定律将①-②×2可得:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=(-632.8kJ/mol)-2×(+269.8kJ/mol)=-1172.4kJ/mol,所以热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol。

【题目】向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
容器 | 甲 | 乙 | 丙 |
温度/℃ | T1 | T2 | T2 |
反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 3.0molA 1.0molB |
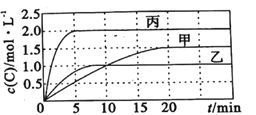
则: (1)该反应为____________(填 “放热反应”或“吸热反应”)
(2)丙容器中前5分钟的A的反应速率为__________
(3)该可逆反应达到平衡后,为在提高反应速率的同时提高B的转化率,可采取的措施有___________(填标号)。
a.按体积比1:1再充入A和B b.改用高效催化剂 c.升高温度 d.增加A的浓度 e. 增加C的浓度
(4)乙容器中的化学平衡常数为_____________