题目内容
11.根据化学反应8NH3+3Cl2═6NH4Cl+N2,回答下列问题:(1)反应中氧化剂是Cl2,被氧化的元素是N.
(2)还原剂与还原产物的物质的量之比为1:3.
(3)当有34g NH3参加反应时,被氧化的氨气的质量为8.5g,生成的还原产物氯化铵的质量为80.25g.
分析 8NH3+3Cl2═6NH4Cl+N2中,N元素的化合价由-3价升高为0,Cl元素的化合价由0降低为-1价,以此来解答.
解答 解:(1)Cl元素的化合价降低,则Cl2为氧化剂,被还原,还原产物为NH4Cl,N元素的化合价升高,失去电子被氧化,还原剂为NH3,
故答案为:Cl2;N;
(2)还原剂为NH3,还原产物为NH4Cl,还原剂与还原产物的物质的量之比是2:6=1:3,故答案为:1:3;
(3)由方程式可知,8molNH3参加反应时,其中2mol作还原剂被氧化,则当有34g、即2molNH3参加反应时,被氧化的物质的质量为2mol×$\frac{1}{4}$×17g/mol=8.5g,生成的还原产物的质量为2mol×$\frac{3}{4}$×53.5g/mol=80.25g,故答案为:8.5;80.25.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及计算的考查,注意8molNH3中只有2mol为还原剂,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
1.下列化合物分子中一定既含σ键又含π键的是( )
| A. | C2H4 | B. | HClO | C. | NH3 | D. | H2O2 |
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol/L Na2CO3溶液中的Na+ 数目为2NA | |
| B. | 7.8 g Na2O2所含离子总数为0.4 NA | |
| C. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 | |
| D. | 34 g OH-中含质子数20NA |
6.能正确表示下列反应的离子方程式是( )
| A. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 氢氧化镁与盐酸的反应:OH-+H +═H2O | |
| C. | Cl2与NaOH 溶液反应:Cl2+2OH-═Cl-+ClO- | |
| D. | 碳酸钙溶于稀盐酸中CaCO3+2H═Ca2++H2O+CO2↑ |
16.将10mL 0.2mol/L CuSO4溶液与20mL 0.15mol/L Ba(OH)2溶液混合,反应后,溶液中离子浓度最大的是( )
| A. | OH- | B. | SO${\;}_{4}^{2-}$ | C. | Ba2+ | D. | Cu2+ |
4.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
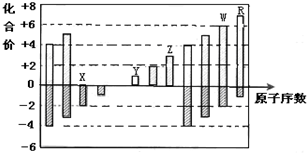

| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R>W | |
| C. | 最高价氧化物的水化物的碱性:Y<Z | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
5.在某一温度下,某碳氢化合物的蒸气对氢气的相对密度为53.则该化合物的分子式为( )
| A. | C8H10 | B. | CH4 | C. | CH3CH2OH | D. | C5H10 |