题目内容
(12分)以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
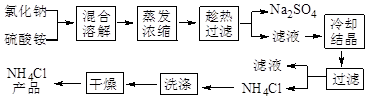
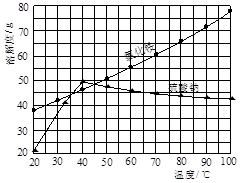
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式: 。
(2)实验室进行蒸发浓缩用到的主要仪器有 、带铁圈的铁架台、玻璃棒、酒精灯等。
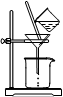
(3)实验过程中趁热过滤的目的是 。冷却结晶后的过滤采用抽滤,其装置如图1所示,请指出该装置中的错误之处 ;
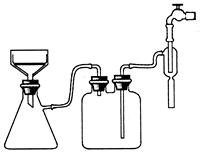
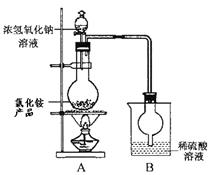
图1 图2
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体 。
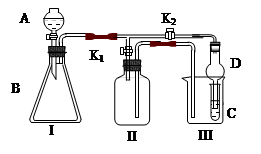
(5)为定粗产品的含氮量,称取11.2gNH4Cl粗产品,用图2装置进行实验,充分反应后,测得B装置增重3.4g。则该粗产品中含氮的质量分数为 。
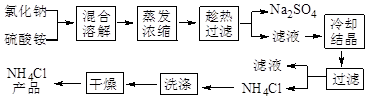
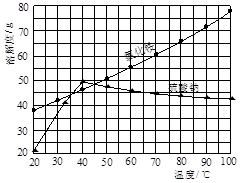
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式: 。
(2)实验室进行蒸发浓缩用到的主要仪器有 、带铁圈的铁架台、玻璃棒、酒精灯等。
(3)实验过程中趁热过滤的目的是 。冷却结晶后的过滤采用抽滤,其装置如图1所示,请指出该装置中的错误之处 ;


图1 图2
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体 。
| A.缓慢冷却溶液 | B.溶液浓度较高 |
| C.溶质溶解度较小 | D.缓慢蒸发溶剂 |
(1) (NH4)2SO4+2NaCl ===2NH4Cl↓+ Na2SO4 (2)蒸发皿
(3)防止温度降低,氯化铵晶体析出而损失、布氏漏斗的颈口斜面未与吸滤瓶的支管口相对
(4) AD (5) 25%
(3)防止温度降低,氯化铵晶体析出而损失、布氏漏斗的颈口斜面未与吸滤瓶的支管口相对
(4) AD (5) 25%
(1)根据反应物和生成物可知,方程式为(NH4)2SO4+2NaCl ===2NH4Cl↓+ Na2SO4。
(2)蒸发浓缩用到的主要仪器是蒸发皿。
(3)由于温度降低,会析出晶体,所以为防止温度降低氯化铵晶体析出而损失,需要趁热过滤。根据装置可判断,错误之处在于布氏漏斗的颈口斜面未与吸滤瓶的支管口相对。
(4)溶液浓度较高或溶质溶解度太小,都不利于得到较大的晶体,答案选AD。
(5)B装置增重3.4g,则生成氨气是3.4g,其物质的量是3.4g÷17g/mol=0.2mol,因此该粗产品中含氮的质量分数为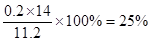 。
。
(2)蒸发浓缩用到的主要仪器是蒸发皿。
(3)由于温度降低,会析出晶体,所以为防止温度降低氯化铵晶体析出而损失,需要趁热过滤。根据装置可判断,错误之处在于布氏漏斗的颈口斜面未与吸滤瓶的支管口相对。
(4)溶液浓度较高或溶质溶解度太小,都不利于得到较大的晶体,答案选AD。
(5)B装置增重3.4g,则生成氨气是3.4g,其物质的量是3.4g÷17g/mol=0.2mol,因此该粗产品中含氮的质量分数为
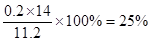 。
。
练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目