题目内容
将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解(产生气体全部逸出),冷却后将溶液稀释至1000ml,测得c(H+)=0.84mol/L;若要使稀释后溶液中的Cu2+沉淀完全,应加入6.0mol/L的NaOH溶液的体积为
| A.100mL | B.160mL | C.240mL | D.307mL |
C
解析试题分析:根据硫酸根守恒有,n(H2SO4)=n(CuSO4)+n(H2SO4过量),n(CuSO4)=18.4×0.05-0.84×1=0.08mol;故V(NaOH)= =0.24L=240mL。
=0.24L=240mL。
考点:考查元素及化合物知识和化学计算,涉及守恒法的应用。

练习册系列答案
相关题目
同温同压下,等质量的下列气体所占有的体积最大的是
| A.O2 | B.CH4 | C.CO2 | D.SO2 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.在反应KIO3 + 6 HI=KI + 3I2+3 H2O中,每生成3mo1 I2转移的电子数为5NA |
| B.100mL 18.4mo1·L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA |
| C.1L 0.1 moI·L-1的CH3COOH溶液中所含的离子和分子总数为0.1NA |
| D.将0.lmol FeC13滴人沸水中可制得0.1NA Fe(OH)3胶粒 |
三草酸合铁酸钾晶体[K3Fe(C2O4)3?xH2O]是一种光敏材料,为测定该晶体中草酸根的含量和结晶水的含量,某实验小组实验步骤为:(1)称量9.820 g三草酸合铁酸钾晶体,配制成250 mL溶液。(2)取所配溶液25.00 mL于锥形瓶中,滴加酸性KMnO4溶液至C2O42-全部转化成CO2,同时MnO4-被转化成Mn2+,恰好消耗0. 1000 mol/L KMnO4溶液24.00 mL。[K3Fe(C2O4)3的相对分子质量为437] 下列说法正确的是
| A.步骤(2)中KMnO4表现还原性 |
| B.配制三草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒 |
| C.样品中结晶水的物质的量为0.03 mol |
| D.该晶体的化学式为K3Fe(C2O4)3?3H2O |
下列叙述正确的是
| A.1.7gOH-离子中含有的电子数目为NA |
| B.常温、常压下,22.4L氧气中含氧原子数目为2NA |
| C.常温下,0.1molC2H4分子中含共价键数目为0.5 NA |
| D.含1molH2SO4的浓硫酸和足量的铜反应转移电子数为NA |
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.2mol/L。若向该混合溶液中加入足量的铜粉。则最多能溶解铜粉的质量为
| A.2.4 g | B.3.2 g | C.6.4 g | D.9.6 g |
下列对应的表达方式错误的是
A.Cl-的结构示意图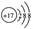 | B.2—甲基丁烷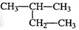 |
C.碳-12原子 C C | D.硫离子的核外电子排布式 1s22s22p63s23p4 |
下列叙述中指定粒子数目一定大于NA的是
| A.常温常压下,11.2LN2和NO的混合气体所含的原子数 |
| B.1molCl2参加化学反应获得的电子数 |
| C.1L1mol/LCH3COOH溶液中所含分子总数 |
| D.28g铁在反应中作还原剂时,失去电子的数目 |
下列解释实验现象的反应方程式正确的是
| A.SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH=Na2SO4+H2O |
B.向K2Cr2O7溶液中加入少量NaOH浓溶液,溶液由橙色变为黄色:Cr2O72—+H2O 2CrO42—+2H+ 2CrO42—+2H+ |
| C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ |
D.铝热反应的原理为:Al2O3+2Fe 2Al+Fe2O3 2Al+Fe2O3 |