题目内容
【题目】某课外活动小组对一氧化碳还原氧化铁的实验中最后的产物产生浓厚兴趣,试通过实验来探究其成分。
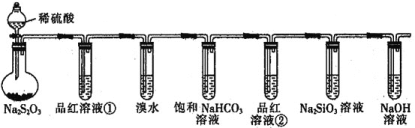
Ⅰ、实验装置:

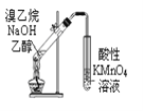
该装置B中发生的离子方程式是 ______,装置B的作用是 ______。
Ⅱ、实验现象:玻璃管A中的粉末由红色逐渐变为黑色时,停止加热,继续通一氧化碳,冷却到室温,停止通气,同时观察到澄清的石灰水变浑浊。
Ⅲ、实验结论:
甲认为:依据上述实验现象可以判断出生成的黑色固体为金属铁。
乙认为:仅从上述实验现象,不足以证明生成的黑色固体为金属铁,他增加一个实验:用磁铁靠近黑色固体,看到有黑色固体被磁铁吸引,于是得出生成的黑色固体为金属铁的结论。
请你通过该反应的相关资料对他们的结论作出判断,并通过实验检验其合理性:
⑴在一定条件下,一氧化碳与氧化铁在加热条件下,可发生如下反应:
CO +3Fe2O3 = 2Fe3O4+ CO2↑ 4CO + Fe3O4 = Fe+ 4CO2↑
⑵四氧化三铁(Fe3O4)为黑色固体,有强磁性,能够被磁铁吸引。
甲、乙同学的结论 ______。你对此评价的理由是 ______。
Ⅳ、实验探究
对反应后固体成分提出假设:
假设1:反应后固体中只有Fe;
假设2:反应后固体中只有Fe3O4;
假设3:反应后固体中 ______ 。
为确定实验中最后产物中的成分,丙同学设计如下实验,请你利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置。
限选试剂和仪器:1mol/L CuSO4、0.01mol/L KSCN溶液、1mol/L 盐酸、0.01mol/L 氨水、试管、玻璃棒、胶头滴管。
实验操作 | 预期现象和结论 |
步骤一;取硬质玻璃管中固体产物少量分别于A、B试管中,加入足量1mol/L CuSO4溶液,搅拌溶解。 | ⑴若A试管中黑色固体不溶解,并且没有观察到其它现象,则黑色固体为 ______。 ⑵若B试管中有红色固体析出,则说明黑色固体中含有 ______。 |
步骤二:对试管B中溶液过滤,将所得固体洗涤干净后加足量1mol/L盐酸后再依次分别加入适量0.01mol/L氨水、少量0.01mol/L KSCN溶液。 | ①若溶液不变红色,则______。 ②若溶液变红色,则______。 |
Ⅴ、延伸探究:丁同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应)______(填“行”或“不行”),理由是:______。
【答案】Ca2+ + 2OH-+ CO2 = H2O + CaCO3↓ 吸收一氧化碳气体中的二氧化碳,便于一氧化碳燃烧 甲乙同学的结论均不正确 铁和四氧化三铁都是黑色固体,都可以被磁铁吸引 Fe和Fe3O4 Fe3O4 Fe 假设1正确 假设3正确 行 等质量氧化铁完全反应生成铁或四氧化三铁,固体质量变化不同
【解析】
Ⅰ、装置B中发生的反应是二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水;吸收生成的二氧化碳,便于一氧化碳燃烧。
Ⅲ、金属铁、四氧化三铁都是黑色固体,都能被磁铁吸引。
Ⅳ、根据假设1和假设2分析得出假设3得到反应后固体。
步骤一:根据分别加入足量1mol/L CuSO4溶液,搅拌溶解,看是否溶解或红色固体析出;步骤二:对试管B中溶液过滤,将所的固体洗涤干净后加足量1mol/L盐酸后再依次分别加入适量0.01mol/L氨水、少量0.01mol/L KSCN溶液,根据①、②现象得出结论。
Ⅴ、等质量氧化铁完全反应生成铁或四氧化三铁,固体质量变化不同,利用反应前后固体质量变化极值分析计算做出判断。
Ⅰ、一氧化碳还原氧化铁反应生成铁和二氧化碳,装置B中发生的反应是二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的离子方程式为:Ca2+ + 2OH-+ CO2 = H2O + CaCO3↓;吸收生成的二氧化碳,便于一氧化碳燃烧,故答案为:Ca2+ + 2OH-+ CO2 = H2O + CaCO3↓;吸收一氧化碳气体中的二氧化碳,便于一氧化碳燃烧。
Ⅲ、甲认为:依据上述实验现象可以判断出生成的黑色固体为金属铁,四氧化三铁也是黑色固体,故甲不合理;乙认为:仅从上述实验现象,不足以证明生成的黑色固体为金属铁,他增加一个实验:用磁铁靠近黑色固体,看到有黑色固体被磁铁吸引,于是得出生成的黑色固体为金属铁的结论,四氧化三铁(Fe3O4)为黑色固体,有强磁性,能够被磁铁吸引,说明乙同学结论不合理;故答案为:甲乙同学的结论不合理;铁和四氧化三铁都是黑色固体,都可以被磁铁吸引。
Ⅳ、根据假设1和假设2分析得出假设3:反应后固体中有Fe和Fe3O4;故答案为:Fe和Fe3O4。
步骤一:取硬质玻璃管中固体产物少量分别与A、B试管中,加入足量1mol/L CuSO4溶液,搅拌溶解,若A试管中黑色固体不溶解,并且没有观察到其它现象,则黑色固体为Fe3O4,若B试管中有红色固体析出,则说明黑色固体中含有Fe;步骤二:对试管B中溶液过滤,将所的固体洗涤干净后加足量1mol/L盐酸后再依次分别加入适量0.01mol/L氨水、少量0.01mol/L KSCN溶液,①若溶液不变红色,则假设1正确;②若溶液变红色,则假设3正确;故答案为:Fe3O4;Fe;假设1正确;假设3正确。
Ⅴ、依据反应前后固体质量的变化来确定黑色固体的成分,等质量氧化铁完全反应生成铁或四氧化三铁,固体质量变化不同,利用反应前后固体质量变化极值分析计算做出判断,所以可以分析判断固体物质组成;故答案为:行;等质量氧化铁完全反应生成铁或四氧化三铁,固体质量变化不同。

【题目】某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应。他们设计了下图装置![]() 夹持装置已略去,装置的气密性良好
夹持装置已略去,装置的气密性良好![]() 进行实验,探究Na2O2与SO2反应的产物,请按要求回答下列问题。
进行实验,探究Na2O2与SO2反应的产物,请按要求回答下列问题。
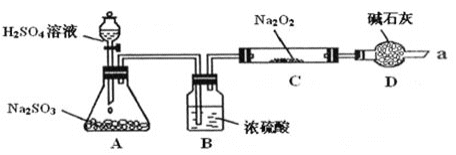
⑴写出装置A中发生反应的化学方程式:_________
⑵装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以__________。
⑶在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;
假设2:_________;
假设3:既有Na2SO3,又有Na2SO4。
a、为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:

甲同学由此得出结论:产物是Na2SO4,该方案是否合理__________![]() 填“是”或“否”
填“是”或“否”![]() ,理由是_______。
,理由是_______。
b、若假设2成立,写出SO2与Na2O2反应的化学方程式:_________。
c、乙同学设计了如下实验进一步确认产物的成分。
实验步骤 | 现象 |
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解。 | 固体全部溶解 |
②向上试管中加入过量的稀盐酸,将生成的气体通入少量酸性KMnO4溶液中。 | 酸性KMnO4溶液褪色 |
③向步骤②反应后的试管中,加入适量的BaCl2溶液。 | 产生白色沉淀 |
步骤②中将产生的气体通入少量酸性KMnO4溶液中,发生反应的离子方程式为: ________,通过上述实验现象确定假设__________成立。(选填1、2或3)。
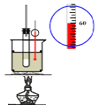
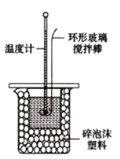
【题目】实验室用50mL 0.50mol/L盐酸、50mL0.55mol/L NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度/℃ | 终止温度/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___。实验中使用环形玻璃搅拌棒的操作方法是____;
(2)在操作正确的前提下,提高中和热测定准确性的关键是_____;
(3)根据表中所测数据进行计算,则该实验测得的中和热![]() =_____ [盐酸和NaOH溶液的密度按1
=_____ [盐酸和NaOH溶液的密度按1![]() 计算,反应后混合溶液的比热容(c)按4.18
计算,反应后混合溶液的比热容(c)按4.18![]() 计算]。如果用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的中和热将______ (填“偏大”“偏小”或“不变”)。
计算]。如果用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的中和热将______ (填“偏大”“偏小”或“不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热数值偏低,请你分析可能的原因是__________;
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 C.做本实验的当天室温较高 D.在量取盐酸时仰视读数 E.大烧杯的盖板中间小孔太大
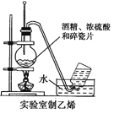
【题目】某化学小组用下图所列装置(固定装置略)验证CO能还原CuO,并探究其还原产物的组成。
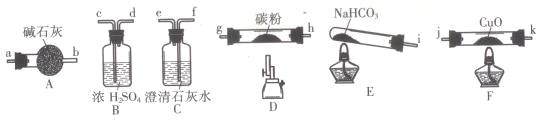
请回答:
(1)按气流方向,各装置从左到右的连接顺序为:
i→______________________________________尾气处理(填仪器接口的字母编号)。
(2)说明CO能还原CuO的实验现象为___________________________。
(3)该实验处理尾气的方法为___________________________。
(4)若去掉B装置,可能产生的影响为___________________________。
(5)将各装置按正确的顺序连接后进行实验。当反应结束后,F处硬质玻璃管中的固体全部变为红色。
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+。
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③________。
[实验验证]该小组为验证上述猜想,分别取少量红色固体放入试管中,进行如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量稀硝酸,振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
b | 加入足量稀硫酸,振荡 | 试管内有红色固体,溶液为无色 |
[实验评价]根据上述实验,不能确定红色固体成分的实验是________(填实验编号),理由为_________(用化学方程式表示)。
[实验结论]根据上述实验结果,可知红色固体的成分为________(填化学式)。