题目内容
下列关于离子交换膜电解槽的叙述,错误的是( )。
| A.精制的饱和食盐水进入阳极室 |
| B.纯水(加少量NaOH)进入阴极室 |
| C.阴极产物为NaOH和氢气 |
| D.电解槽的阳极用金属铁网制成 |
D
离子交换膜电解槽阳极产物为Cl2,阴极为NaOH和H2,阳极发生氧化反应:2Cl--2e-=Cl2↑,若是铁做阳极,则Fe原子失去电子,阳极不会得到Cl2;阴极发生还原反应:2H++2e-=H2↑,需补充H2O,Na+自阳极室进入阴极室后,与OH-形成NaOH。故选D。

练习册系列答案
相关题目
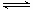 2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1
2MgCl2(aq) +SiO2 (s) + 2H2O(l) △H =-49.04 kJ·mol-1
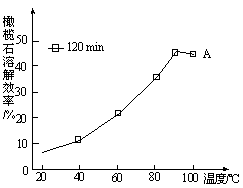
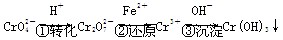
 Cr2O(橙色)+H2O
Cr2O(橙色)+H2O