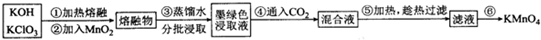题目内容
17.工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2?CH3OH+H2O.请回答下列问题:(1)已知常温常压下下列反应的能量变化如图所示:

写出由二氧化碳和氢气制备甲醇的热化学方程式CO2(g)+3H2(g)=CH3OH(1)+H2O(1)△H=-50kJ/mol
该反应的△S<0(填“>”或“<”或“=”),在低温情况下有利于该反应自发进行.
(2)如果上述反应方程式的平衡常数K值变大,则该反应AD(选填编号).
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
(3)若反应的容器容积为2.0L,反应时间4.0min,容器内氢气的质量减少了4.8克,在这段时间内CO2的平均反应速率为0.1mol•L-1•min-1.
分析 (1)根据图1中能量变化写出反应的热化学方程式,然后根据盖斯定律写出由二氧化碳和氢气制备甲醇的热化学方程式;根据反应前后气体体积的变化判断△S;△G=△H-T•△S进行判断,如△G<0,则反应能自发进行,如△G>0,则不能自发进行;
(2)平衡常数只受温度的影响,该反应为放热反应,平衡常数增大,则平衡向着正向移动,说明降低了温度,据此进行解答;
(3)根据差量法计算出反应消耗的二氧化碳的物质的量,再根据v=$\frac{△c}{△t}$进行计算.
解答 解:(1)图1中的热化学方程式为①CO(g)+H2O(l)=CO2(g)+H2(g)△H=-41kJ/mol,
②CO(g)+2H2(g)=CH3OH(l)△H=-(510-419)kJ/mol=-91KJ/mol,
依据盖斯定律②-①得:二氧化碳和氢气制备甲醇的热化学方程式:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;
该反应前后气体体积减小,则△S<0;
△G=△H-T•△S<0时,反应能够自发进行,由于该反应为放热反应,△H<0,而△S<0,则温度降低时△G<0,该反应自发进行,
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol;<;低温;
(2)如果反应方程式CO2+3H2?CH3OH+H2O的平衡常数K值变大,则需要降低温度,
A.降低温度,平衡一定向着正向移动,故A正确;
B.降低温度后,正逆反应速率都减小,正反应速率在达到平衡前始终在减小,故B错误;
C.平衡常数变大,反应物浓度减小,生成物浓度增大,则化学平衡一定向着正向移动,故C错误;
D.化学平衡常数变大,需要降低温度,则正逆反应速率都减小,由于平衡向着正向移动,则逆反应速率先减小后增大,故D正确;
故答案为:AD;
(3)若反应的容器容积为2.0L,反应时间4.0min,容器内氢气的质量减少了4.8克,物质的量=$\frac{4.8g}{2g/mol}$=2.4mol,二氧化碳减少物质的量为0.8mol,在这段时间内CO2的平均反应速率=$\frac{\frac{0.8mol}{2.0L}}{4.0min}$=0.1mol•L-1•min-1,
故答案为:0.1mol•L-1•min-1.
点评 本题考查了热化学方程式的书写、化学反应速率的计算、化学平衡状态的判断等知识,题目难度中等,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况,试题有利于培养学生的分析、理解能力及化学计算能力.

| A. | 均三甲苯在核磁共振氢谱中能出现两组峰,且其峰面积之比为3:1 | |
| B. | 按系统命名法,化合物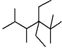 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 | |
| C. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| D. | 肌醇 与葡萄糖 与葡萄糖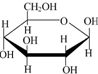 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 |
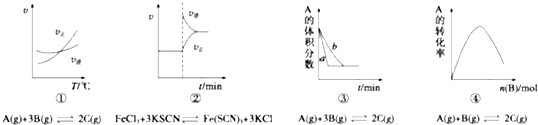
| A. | ①是其他条件一定时,反应速率随温度变化的图象,则正反应△H>0 | |
| B. | ②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图象 | |
| C. | ③是在有无催化剂存在条件下,建立平衡过程的图象,b是使用催化剂时的曲线 | |
| D. | ④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图象 |
| A. | 阿伏加德罗常数是一个纯数,没有单位 | |
| B. | 阿伏加德罗常数就是6.02×1023 mol-1 | |
| C. | 阿伏加德罗常数数值上等于0.012Kg C所含的碳原子数 | |
| D. | 阿伏加德罗常数是指1mol的任何粒子集合体中含有的粒子数 |
| A. | 二氧化硅是良好的半导体材料,可用于制造集成电路、晶体管器件和硅芯片等 | |
| B. | 硅的化学性质很稳定,常温下与酸、碱、盐等难以反应 | |
| C. | 硅酸俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 向含有少量酚酞的硅酸钠溶液中逐滴加入稀盐酸,边加边振荡,可以看到溶液红色逐渐消失 |
| A. | 质量相等、密度不等的N2和C2H4 | B. | 相同压强、相同体积的CO和O2 | ||
| C. | 相同温度、相同体积的O2和N2 | D. | 质量相等的N2和CO2 |