题目内容
12.38g某二价金属氯化物(ACl2)中含有0.8mol Cl-,则ACl2的摩尔质量是95g/mol;A的相对原子质量是24;ACl2的化学式是MgCl2.分析 金属氯化物(ACl2)中含有0.8mol Cl-,则ACl2的物质的量为0.4mol,根据M=$\frac{m}{n}$计算ACl2的摩尔质量,进而计算A的相对原子质量,可以确定A的元素符号,确定ACl2的化学式.
解答 解:38g某二价金属氯化物(ACl2)中含有0.8mol Cl-,ACl2的物质的量为$\frac{0.8mol}{2}$=0.4mol,则ACl2的摩尔质量是$\frac{38g}{0.4mol}$=95g/mol,A的相对原子质量是95-35.5×2=24,故A为Mg元素,ACl2的化学式是MgCl2,
故答案为:95g/mol;24;MgCl2.
点评 本题考查物质的量有关计算,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
20.下列实验及操作方法正确的是( )
| A. | 配制一定物质的量浓度的溶液时,若摇匀后发现液面低于刻度线,要再用胶头滴管加水至刻度线 | |
| B. | 除去FeCl2溶液中的少量FeBr2,可先加入适量氯水,再用CCl4萃取分液 | |
| C. | 为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用 | |
| D. | 向溶液中先加入KSCN溶液无明显现象,再加入新制氯水,溶液呈红色,证明原溶液中含有Fe2+ |
7.从溴乙烷制取1,2-二溴乙烷,下列制备方案中最好的是( )
| A. | CH3CH2Br$\stackrel{NaOH水溶液}{→}$CH3CH2OH$\stackrel{浓硫酸,170℃}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
1.升高温度,气体摩尔体积( )
| A. | 随气体分子数目变化 | B. | 随气体分子间距变化 | ||
| C. | 一定增大 | D. | 一定减小 |
2.对反应:4NH3+5O2═4NO+6H2O来说,改变下列条件使反应速率加大,其中是由于增大了“单位体积内的活化分子数”的是( )
| A. | 用铂作催化剂 | B. | 升高温度 | ||
| C. | 缩小体积增大压强 | D. | 增大接触面积 |
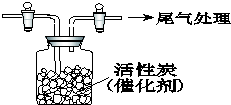 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
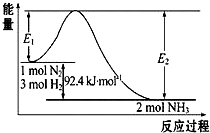 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题: