题目内容
8.利胆解痉药“亮菌甲素”跟(CH3)2SO4反应生成A.二者的结构简式如图1.试回答: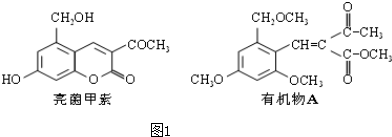
(1)“亮菌甲素”的分子式为C12H10O5,1mol“亮菌甲素”跟浓溴水反应时最多消耗
3mol Br2;有机物A不能发生的化学反应有②④.(填序号)
①可以跟溴水反应生成白色沉淀 ②可以使KMnO4(H+)溶液褪色 ③可以与H2加成
④可以使FeCl3溶液显紫色 ⑤可以与NaOH溶液反应 ⑥可以发生加聚反应
(2)有机物A能发生如图2转化.
提示:
i
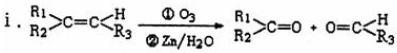
iiR-O-CH3$\stackrel{HCl}{→}$ROH(R为脂肪烃或芳香烃的烃基)
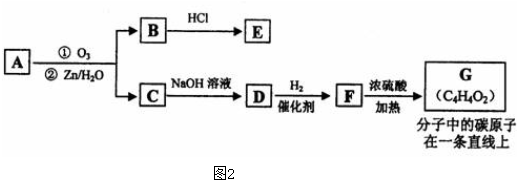
①C→D的化学方程式为
 .
.②1mol G跟1mol H2在一定条件下反应,生成物的结构简式为CH3-CH=CH-COOH.
③符合下列条件的E的同分异构体有4种,写出其中任意一种的结构简式
 (其中一种).
(其中一种).a.遇FeCl3溶液呈紫色 b.不能发生水解反应,能发生银镜反应
c.苯环上的一氯取代物只有一种,分子中无甲基.
分析 (1)根据亮菌甲素的结构式可判断出,1个亮菌甲素中含有12个C原子,10个H原子以及5个O原子,以此书写分子式;1mol亮菌甲素中含有1mol酚羟基,苯环中有有2mol邻位H原子可被取代,含有1molC=C键,发生加成反应消耗1mol溴,共3mol,根据官能团的性质判断该有机物可能具有的性质;
(2)根据题中信息,A在臭氧作用下反应生成B和C,根据化合价的断裂方式可知,B为 ,C为
,C为 ,C在NaOH作用下水解生成D,D为
,C在NaOH作用下水解生成D,D为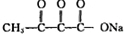 ,D加成生成F,F为
,D加成生成F,F为 ,F在浓硫酸作用发生消去反应,根据题给信息可知最终产物为G,G为CH3-C≡C-COOH,据此答题.
,F在浓硫酸作用发生消去反应,根据题给信息可知最终产物为G,G为CH3-C≡C-COOH,据此答题.
解答 解:(1)根据亮菌甲素的结构式可判断出,1个亮菌甲素中含有12个C原子,10个H原子以及5个O原子,
故分子式为C12H10O5,1mol亮菌甲素中含有1mol酚羟基,苯环中有有2mol邻位H原子可被取代,含有1molC=C键,发生加成反应消耗1mol溴,共3mol,有机物A中含有C=C键和酯基等官能团,能发生加成、取代能发生,但不能发生水解和消去反应,
故答案为:C12H10O5;3;②④;
(2)根据题中信息,A在臭氧作用下反应生成B和C,根据化合价的断裂方式可知,B为 ,C为
,C为 ,C在NaOH作用下水解生成D,D为
,C在NaOH作用下水解生成D,D为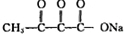 ,D加成生成F,F为
,D加成生成F,F为 ,F在浓硫酸作用发生消去反应,根据题给信息可知最终产物为G,G为CH3-C≡C-COOH,以此解答以下各问:
,F在浓硫酸作用发生消去反应,根据题给信息可知最终产物为G,G为CH3-C≡C-COOH,以此解答以下各问:
①根据题中信息,A在臭氧作用下反应生成B和C,根据化合价的断裂方式可知,B为 ,C为
,C为 ,C在NaOH作用下水解生成D,D为
,C在NaOH作用下水解生成D,D为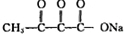 ,C→D的化学方程式为,
,C→D的化学方程式为,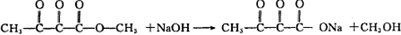 ,
,
故答案为: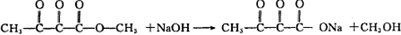 ;
;
②D加成生成F,F为 ,F在浓硫酸作用发生消去反应,根据题给信息可知最终产物为G,G为CH3-C≡C-COOH,1mol G跟1mol H2在一定条件下反应,生成物为CH3-CH=CH-COOH,
,F在浓硫酸作用发生消去反应,根据题给信息可知最终产物为G,G为CH3-C≡C-COOH,1mol G跟1mol H2在一定条件下反应,生成物为CH3-CH=CH-COOH,
故答案为:CH3-CH=CH-COOH;
③根据题给信息,B在HCl作用下发生取代反应生成醇,则E为 ,其同分异构体的结构和性质特点为a.遇FeCl3溶液呈紫色;b.不能发生水解反应,但能发生银镜反应;c.苯环上的一氯取代物只有一种,且分子中无甲基,说明结构中苯环上连有羟基,结构中含有醛基但不含酯基,结构对称,苯环上只有一种等效氢原子,根据这些结构和性质特点可写出可能的结构有4种,分别为:
,其同分异构体的结构和性质特点为a.遇FeCl3溶液呈紫色;b.不能发生水解反应,但能发生银镜反应;c.苯环上的一氯取代物只有一种,且分子中无甲基,说明结构中苯环上连有羟基,结构中含有醛基但不含酯基,结构对称,苯环上只有一种等效氢原子,根据这些结构和性质特点可写出可能的结构有4种,分别为: ,
,
故答案为:4; (其中一种).
(其中一种).
点评 本题考查有机物的推断和合成,题目较为综合,有一定的难度,做题时注意把利用好题给信息,采用正逆推相结合的方法推断,注意同分异构体的判断方法.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案 苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理如图1和实验主要装置如图2:
苯甲酸及其钠盐可用作乳胶、牙膏、果酱及其它食品的防腐剂,也可用作染色和印色的媒染剂.某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸,制备原理如图1和实验主要装置如图2:已知:①甲苯为无色澄清液体,微溶于水,沸点110.6℃.
②苯甲酸的熔点为122.4℃.
③苯甲酸在25℃和95℃时的溶解度分别为0.17g和6.8g.
实验流程:
Ⅰ、往三颈烧瓶中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,回流反应4小时.
Ⅱ、将反应混合物趁热过滤,洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作B得白色较干燥粗产品.
Ⅲ、纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol•L-1KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(1)仪器A的名称(球形)冷凝管;
(2)判断甲苯被氧化完全的实验现象是甲苯层消失,回流液不再有明显的油珠;
(3)洗涤时,下列洗涤剂最合适的是B
A、冷水 B、热水 C、乙醇 D、乙醇-水混合物
(4)根据实验流程Ⅱ,回答下列两个问题:
①操作B的名称过滤;
②如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是将过量的KMnO4反应掉,防止其与浓盐酸反应;
(5)实验所得的苯甲酸在结晶过程中常裹携KCl析出,除去产品中KCl的实验方法的名称是重结晶;
(6)样品中苯甲酸纯度为96.00%.
①HF(aq)+OH-(aq)?F-(aq)+H2O(1)△H=-67.7kJ/mol
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ/mol
下列有关说法中正确的是( )
| A. | HF电离吸热 | |
| B. | 水解消耗0.1 mol F时,吸收的热量为6.77 kJ | |
| C. | 中和热均为57.3 kJ/mol | |
| D. | 含0.1 mol HF、0.1 mol NaOH的两种溶液混合后放出的热量为6.77 kJ |
| A. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉就会溶解 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 白纸上滴加浓硫酸后变黑体现了浓硫酸的吸水性 | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实验完成 |

(1)某元素原子的核外所有p电子数比s电子总数少1,则该元素的元素符号是N.
(2)元素⑨的基态原子的外围电子排布式是3d54s1,该元素的最高正价是+6.
(3)元素⑩在周期表中的位置是第四周期、第Ⅷ族、d区.
(4)表中元素⑥的氢化物的还原性比元素⑤的氢化物的还原性弱(填强或弱)
(5)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.下表是一些气态原子失去核外不同电子所需的能量(电离能)(KJ•mol-):
| 锂 | X | |
| 失去第一个电子(I1) | 519 | 580 |
| 失去第二个电子(I2) | 7296 | 1820 |
| 失去第三个电子(I3) | 11799 | 2750 |
| 失去第四个电子(I4) | 11600 |
| A. | AgNO3溶液 | B. | NaOH溶液 | C. | Fe3O4 | D. | MgO |
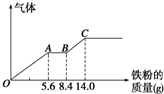 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).请填空:
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).请填空: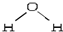 ,折线型结构,正负电荷的重心不能重合,因此为极性分子;CO2的结构式为 O═C═O,正负 电荷的重心重合,为非极性分子.又知极性分子易溶于极性分子中,而非极性分子易溶于非极性分子中,叫相似相溶原理.
,折线型结构,正负电荷的重心不能重合,因此为极性分子;CO2的结构式为 O═C═O,正负 电荷的重心重合,为非极性分子.又知极性分子易溶于极性分子中,而非极性分子易溶于非极性分子中,叫相似相溶原理.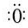 →
→ .
.