题目内容
运用相关原理,回答下列各小题:
已知:NaHSO4在水中的电离方程式为NaHSO4═Na++H++SO42-.
(1)常温下,pH=5的NaHSO4溶液中水的电离程度 (填“>”、”=”或“<”)pH=9的氨水中水的电离程度.
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为: (用离子方程式表示);
若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH4+) c(SO42-)(填“>”、“=”或“<”);
用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7(填“>”、”=”或“<”).
(3)工业上常用电解饱和食盐水的方法制备氯气,如果在饱和食盐水中滴加酚酞,通电后 (填阴极或阳极)极附近溶液变红,写出电解饱和食盐水的化学方程式 .
已知:NaHSO4在水中的电离方程式为NaHSO4═Na++H++SO42-.
(1)常温下,pH=5的NaHSO4溶液中水的电离程度
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为:
若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH4+)
用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH
(3)工业上常用电解饱和食盐水的方法制备氯气,如果在饱和食盐水中滴加酚酞,通电后
考点:弱电解质在水溶液中的电离平衡,电解原理
专题:电离平衡与溶液的pH专题,电化学专题
分析:(1)酸或碱都抑制水电离,根据酸中氢离子浓度和碱中氢氧根离子浓度确定抑制水电离程度;
(2)物质的量相等的硫酸氢钠和氨水反应生成硫酸钠、硫酸铵,硫酸铵为强酸弱碱盐,其溶液呈酸性;
混合溶液呈中性,则c(H+)=c(OH-),再结合电荷守恒判断;
用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,二者以1:1反应,生成硫酸钡、水和NaOH,据此判断溶液酸碱性;
(3)用石墨作电极电解饱和食盐水时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近生成氢氧根离子,溶液碱性增强,无色酚酞试液遇碱变红色.
(2)物质的量相等的硫酸氢钠和氨水反应生成硫酸钠、硫酸铵,硫酸铵为强酸弱碱盐,其溶液呈酸性;
混合溶液呈中性,则c(H+)=c(OH-),再结合电荷守恒判断;
用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,二者以1:1反应,生成硫酸钡、水和NaOH,据此判断溶液酸碱性;
(3)用石墨作电极电解饱和食盐水时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近生成氢氧根离子,溶液碱性增强,无色酚酞试液遇碱变红色.
解答:
解:(1)酸或碱都抑制水电离,常温下,pH=5的NaHSO4溶液中氢离子浓度为10-5 mol/L,pH=9的氨水中氢氧根离子浓度为10-5 mol/L,所以二者抑制水电离程度相等,故答案为:=;
(2)物质的量相等的硫酸氢钠和氨水反应生成硫酸钠、硫酸铵,硫酸铵为强酸弱碱盐,铵根离子水解导致其溶液呈酸性,离子方程式为NH4++H2O?NH3.H2O+OH-;
混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(NH4+)=2c(SO42-),所以c(Na+)+c(NH4+)>c(SO42-);
用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,二者以1:1反应,生成硫酸钡、水和NaOH,溶液呈碱性,则溶液的pH>7;
故答案为:NH4++H2O?NH3.H2O+OH-;>;>;
(3)用石墨作电极电解饱和食盐水时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近生成氢氧根离子,溶液碱性增强,无色酚酞试液遇碱变红色,所以阴极附近溶液变红色,电池反应式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑,故答案为:阴极;2NaCl+2H2O
2NaOH+Cl2↑+H2↑.
(2)物质的量相等的硫酸氢钠和氨水反应生成硫酸钠、硫酸铵,硫酸铵为强酸弱碱盐,铵根离子水解导致其溶液呈酸性,离子方程式为NH4++H2O?NH3.H2O+OH-;
混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(NH4+)=2c(SO42-),所以c(Na+)+c(NH4+)>c(SO42-);
用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,二者以1:1反应,生成硫酸钡、水和NaOH,溶液呈碱性,则溶液的pH>7;
故答案为:NH4++H2O?NH3.H2O+OH-;>;>;
(3)用石墨作电极电解饱和食盐水时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近生成氢氧根离子,溶液碱性增强,无色酚酞试液遇碱变红色,所以阴极附近溶液变红色,电池反应式为2NaCl+2H2O
| ||
| ||
点评:本题考查了弱电解质电离、电解原理,根据溶液中的溶质性质确定溶液酸碱性,知道电解原理中离子放电顺序,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
关于苯的叙述中正确的是( )
| A、苯在催化剂作用下能与液溴发生取代反应 |
| B、在苯中加入酸性KMnO4溶液,紫色褪去 |
| C、在苯中加入溴水,振荡并静置后下层液体为橙黄色 |
| D、在一定条件下,苯能与氯气发生加成反应 |
能证明Al的金属性比Mg弱的实验事实是( )
| A、Al的导电性比Mg强 |
| B、Al的原子半径比Mg小 |
| C、Al(OH)3能溶于NaOH溶液,而Mg(OH)2则不能 |
| D、Mg(OH)2的溶解性比Al(OH)3的溶解性略大 |


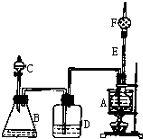 已知,CH3CH2OH+NaBr+H2SO4
已知,CH3CH2OH+NaBr+H2SO4