题目内容
5.利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
(1)写出A装置中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O
(2)B装置主要有三种功能:①干燥混合气体②控制气流速度③均匀混合气体;
(3)设$\frac{V(C{I}_{2})}{V(C{H}_{4})}$=x,若理论上欲获得最多的氯化氢,则x的值应≥4
(4)D装置中棉花上均匀滴有足量淀粉KI浓溶液,其作用是吸收过量的氯气,一段时间后发现棉花由白色变为蓝色.
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出反应的化学方程式CH4+2Cl2 $\stackrel{光照}{→}$C+4HCl.
(6)E装置中使用球形干燥管的作用是防倒吸
(7)E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为A(填字母).
A.分液法 B.蒸馏法 C.过滤 D.结晶法.
分析 实验室用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经干燥后和甲烷在光照条件下发生取代反应,生成多种氯代烃和HCl,在强光照射下可发生CH4+2Cl2 $\stackrel{光照}{→}$C+4HCl,生成的黑色小颗粒为炭黑,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离.
(1)A装置为制备氯气,二氧化锰与浓盐酸反应生成氯化锰、氯气和水;
(2)浓硫酸可以干燥氯气和氯化氢,根据冒出气泡的速率来控制气体硫酸;
(3)甲烷可以和氯气发生取代反应,产物为氯化氢和二氯甲烷、三氯甲烷和四氯化碳;
(4)氯气能将碘化钾氧化为碘单质,碘单质遇到淀粉会变蓝色;
(5)甲烷可以和氯气发生取代反应生成碳和氯化氢;
(6)反应产物中含有氯化氢,易溶于水需要防止倒吸;
(7)最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离.
解答 解:实验室用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经干燥后和甲烷在光照条件下发生取代反应,生成多种氯代烃和HCl,在强光照射下可发生CH4+2Cl2 $\stackrel{光照}{→}$C+4HCl,生成的黑色小颗粒为炭黑,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离.
(1)A装置为制备氯气,二氧化锰与浓盐酸反应生成氯化锰、氯气和水,其反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)生成的氯气中含有水,B装置除具有控制气流速度、均匀混合气体之外,因浓硫酸具有吸水性,还具有干燥作用,
故答案为:干燥混合气体;控制气流速度;
(3)氯气与甲烷发生取代反应,反应特点是1mol氯气可取代1molH原子生成1molHCl,设$\frac{V(C{l}_{2})}{V(C{H}_{4})}$=x,若理论上欲获得最多的氯化氢,则x值应保证甲烷被完全取代,x应大于或等于4,
故答案为:≥4;
(4)氯气具有氧化性,KI中-1价的碘能被氯气氧化,产物为氯化钾固体和碘单质,所以棉花上均匀滴有足量淀粉KI浓溶液,能吸收过量的氯气,生成碘单质与淀粉在一起会变蓝色;
故答案为:吸收过量的氯气;蓝;
(5)生成的黑色小颗粒为炭黑,在强光照射下可发生反应:CH4+2Cl2 $\stackrel{光照}{→}$C+4HCl,
故答案为:CH4+2Cl2 $\stackrel{光照}{→}$ C+4HCl;
(6)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,则装置E是吸收HCl的装置,由于氯化氢易溶于水需要防止倒吸,所以要用使用球形干燥管来防止倒吸;
故答案为:防倒吸;
(7)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开;
故答案为:A.
点评 本题考查了物质制备和性质实验设计,主要考查了氯气的制备以及甲烷与氯气的取代反应,题目难度中等,侧重于考查学生的实验探究能力和对基础知识的综合应用能力.

| A. | $\frac{1}{2}$(lgc-lgb) | B. | $\frac{1}{2}$(lgb-lgc) | C. | $\frac{1}{2}$(lgb-lgc)-a | D. | $\frac{1}{2}$(lgc-lgb)-a |
| A. | 用水鉴别乙醇、苯和CCl4 | |
| B. | 用燃烧法鉴别甲烷、乙炔和四氧化碳 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用酸性高锰酸钾溶液鉴别乙炔、乙烯和丙烷 |
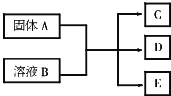 A、B、C、D、E均为中学化学中的常见物质,它们之间的反应关系如图所示:
A、B、C、D、E均为中学化学中的常见物质,它们之间的反应关系如图所示: