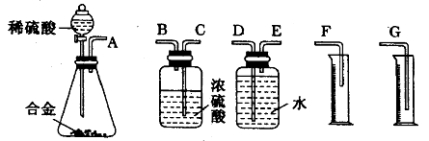
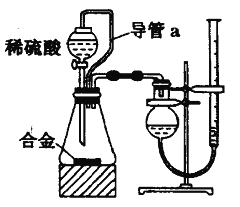
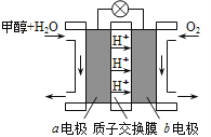
题目内容
【题目】下列叙述正确的是
A. 含有最低价元素的化合物不一定具有很强的还原性
B. 元素的单质一定是由氧化或还原该元素的化合物制得
C. 阳离子只能得电子被还原,阴离子只能失电子被氧化
D. 在化学反应中,得电子越多的氧化剂,其氧化性就越强
【答案】A
【解析】试题分析:A.元素处于最低价,可能具有强的还原性,比如S2-,也可能还原性很弱,比如F-,因此A正确。B.3O2=2O3此反应说明B错误。C.阳离子或阴离子的化合价处于中间价态,既能被氧化又能被还原只能得电子被还原,因此C错误。D.氧化剂得电子能力越强,其其氧化性就越强,但是得电子越多,氧化性不一定越强,因此D错误。

练习册系列答案
相关题目
【题目】常温下,将某一元酸HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)在①组实验中0.1 mol·L-1HA溶液中水的电离程度为a,0.1 mol·L-1NaOH溶液中水的电离程度为b,所得混合溶液中水的电离程度为c.则a、b、c由大到小的顺序是_________.
(2)在②组实验中c_____0.2(填“<”、“>”或“=”)
(3)根据③组实验所得的混合溶液,其溶液中离子浓度大小排列顺序是____________.
(4)常温下,已知KSP[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于_________.