题目内容
【题目】铝镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
【方案一】
【实验方案】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是__________.
【实验步骤】
(1)称取10.8g铝镁合金粉末样品,溶于V mL 物质的量浓度为4.0mol/L NaOH溶液中,充分反应。则NaOH溶液的体积V≥______mL。
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将__________(填“偏高”、“偏低”或“无影响”).
【方案二】
【实验方案】将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积.
【实验步骤】
(1)同学们拟选用下列实验装置完成实验:
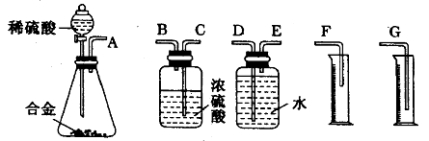
你认为最简易的装置其连接顺序是:A→( )→( )→( )→( )→( )(填接口字母,可不填满)。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
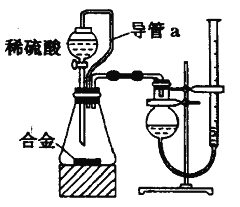
①与前面(1)中装置相比该装置中导管a的作用有 .
②实验中将碱式滴定管改装成量气管,且实验前后量气管中液面读数分别为V1 mL、V2 mL.则产生氢气的体积为__________mL。
③若需确定产生氢气的物质的量,还需测定的数据是 。
【答案】【方案一】2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(1)97mL;(2)偏高;
【方案二】(1)E、D、G;(2)①平衡压强,减少因滴入稀硫酸带来的体积误差;
② V1-V2;;③实验时的温度和压强;
【解析】
试题分析:方案一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(1)含镁为3%时,金属铝的含量最高,10.8g合金中铝的质量为,10.8g×(1-3%)=10.8×97%g,则:
2Al + 2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
10.8g×97% V×10-3L×4.0mol/L
所以54g:(10.8g×97%)=2mol:(V×10-3L×4.0mol/L),解得:V=97,故V(NaOH溶液)≥97mL,故答案为:97mL;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,故答案为:偏高;
方案二:(1)装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(G),故答案为:E、D、G;
(2)①装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差,故答案为:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
②滴定管的数值零刻度在上方,两次的体积之差为测定的氢气的体积,收集氢气后滴定管内液面读数减小,所以测定氢气的体积为V1-V2,故答案为:V1-V2,
③由于气体受温度和压强的影响较大,若要确定气体的物质的量,必须知道实验时的温度和压强,故答案为:实验时的温度和压强。

 阅读快车系列答案
阅读快车系列答案【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:

(1)金属M为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)CoC2O4﹒2H2O高温焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其目的是 ,90℃时Ksp(Li2CO3)的值为 。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
【题目】从能量的变化和反应的快慢等角度研究反应具有重要意义。
(1)已知反应2H2+O2 =2H2O为放热反应,下图能正确表示该反应中能量变化的是 。

化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如右表:则生成1mol水可以放出热量____________kJ
(2)原电池可将化学能转化为电能。将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是 , 正极的反应式为 ,电解质溶液中SO42- 移向 极(填“正”或“负”)。一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。