题目内容
反应P(g)+Q(g) M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是
M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是
 M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是
M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是| A.减小容器体积,平衡不移动 | B.加入催化剂,M的产率增大 |
| C.增大c(P),P的转化率增大 | D.降低温度,Q的转化率增大 |
D
试题分析:A、正向是体积减小的方向,因此减小容器的体积,相当于增大压强,那么平衡正向移动,错误;B、加入催化剂,平衡不移动,产率不变,改变的仅仅是反应速率,错误;C、增大P的浓度,平衡正向移动,但是P的转化率减小,错误;D、降低温度,平衡正向移动,Q的转化率增大,正确。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
 C(g)
C(g) 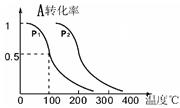
 p C在某温度下达到平衡
p C在某温度下达到平衡 2R(g)△H>0,y 轴表示的是
2R(g)△H>0,y 轴表示的是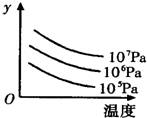
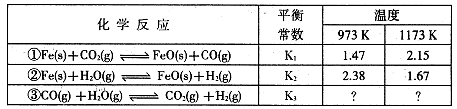
 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下: Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
 CH3OH(g)
CH3OH(g)
 H2S(g) △H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
H2S(g) △H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。