题目内容
【题目】为迎接G20峰会的到来,浙江加大了对环境治理的力度.其中对含氮化物的处理是一个重要的课题.
(1)氮氧化物
(I)已知:N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况如图1: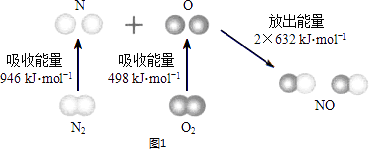
①2NO(g)N2(g)+O2(g)△H=
②你认为该反应能否自发,并说明理由
(II)科学家利用2NO(g)Na(g)+O2(g)来消除NO的污染.1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol.在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,第25min时到达平衡;第30min时,保持温度和体积不变,向容器中再通入0.2molNO,第50min时达到平衡,请在图2中画出从第15min起到70minNO的物质的量随时间变化的曲线 . 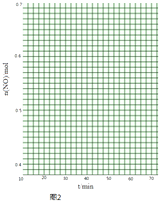
(2)亚硝酸盐
(I)来源:用氧化性熔融盐处理钢铁表面氧化膜时会产生污染物亚硝酸盐,请写出FeO与NaNO3在加热条件下发生的反应 .
(II)电化学处理:用电解法降解NO2其原理如图3所示
电源正极为(填A或B),
阴极反应式为 . 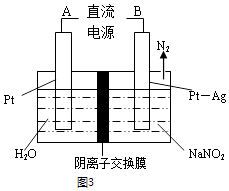
【答案】
(1)﹣180kJ/mol;该反应△H<0,若△S>0则反应一定自发;若△S<0则反应在低温下自发;
(2)2FeO+NaNO3 ![]() Fe2O3+NaNO2;A;2NO2﹣+6e﹣+4H2O=N2↑+8OH﹣
Fe2O3+NaNO2;A;2NO2﹣+6e﹣+4H2O=N2↑+8OH﹣
【解析】解:(1)(I)①2NO(g)N2(g)+O2(g),反应热等于生成物的键能﹣反应物的键能,△H=(2×632kJ/mol)﹣(946kJ/mol+498kJ/mol)=﹣180kJ/mol,所以答案是:﹣180kJ/mol;②该反应的△H<0,如能自发进行,应满足△H﹣T△S<0,△S不确定,则若△S>0则反应一定自发;若△S<0则反应在低温下自发,
所以答案是:该反应△H<0,若△S>0则反应一定自发;若△S<0则反应在低温下自发;(II)1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol.在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,因反应前后体积不变,则平衡不移动,第30min时,保持温度和体积不变,向容器中再通入0.2molNO,NO物质的量增大,且平衡逆向移动,达到平衡时,各物质的含量不变,第50min时达到平衡,NO的物质的量应变为0.48mol,则图象为  ,
,
所以答案是: 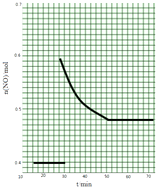 ;
;
·(2)(I)FeO与NaNO3在加热条件下发生反应生成氧化铜和亚硝酸钠,方程式为2FeO+NaNO3 ![]() Fe2O3+NaNO2 ,
Fe2O3+NaNO2 ,
所以答案是:2FeO+NaNO3 ![]() Fe2O3+NaNO2;(II)用电解法降解NO2其原理如图3所示,NO2在阴极被还原生成氮气,则A为正极,B为负极,阴极发生2NO2﹣+6e﹣+4H2O=N2↑+8OH﹣ ,
Fe2O3+NaNO2;(II)用电解法降解NO2其原理如图3所示,NO2在阴极被还原生成氮气,则A为正极,B为负极,阴极发生2NO2﹣+6e﹣+4H2O=N2↑+8OH﹣ ,
所以答案是:A; 2NO2﹣+6e﹣+4H2O=N2↑+8OH﹣ .

【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ/mol
③H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式: .
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)4CO2(g)+N2(g)△H=﹣1200kJmol﹣1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是(填代号).
(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.3 0 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0﹣20min的平均反应速率v(NO)=;计算该反应的平衡常数K= .
②30min后,只改变某一条件,根据表的数据判断改变的条件可能是(填字母代号).
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率(填“升高”或“降低”),a0(填“>”或“<”).
(4)温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=bkJ/mol.测得有关数据如表:
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 /td> | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是
A.T1>T2 , 且b>0
B.当温度为T2、反应进行到40min时,x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50mol CH4和1.2mol NO2 , 重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50mol CH4(g)、0.50molNO2(g)、1.0mol N2(g)、2.0molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)