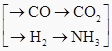题目内容
【题目】某同学设计了如图装置用于制取SO2 , 并验证SO2的部分性质,回答下列问题 
(1)装置A中用于添加浓硫酸的仪器名称为
(2)某同学为了检验装置中A、B两部分的气密性,进行的操作是:关闭弹簧夹a、打开弹簧夹b,用酒精灯在三口烧瓶下微热,观察到B中长导管口有明显气泡现象,他判断气密性良好.你认为是否合理(填“合理”或“不合理”)
(3)实验前要在装置中鼓入N2 , 目的是
(4)为了验证SO2是酸性氧化物,B中可选用的试剂是
A.无色酚酞溶液
B.蓝色石蕊试剂
C.红色品红溶液
D.KI淀粉混合溶液
(5)装置C中可观察到白色沉淀现象,由此可验证SO2具有性,相关反应的总的离子方程式为 .
【答案】
(1)分液漏斗
(2)不合理
(3)排净装置中的空气,防止溶液中SO2被空气中的O2氧化而干扰实验
(4)B
(5)还原性;Ba2++2Fe3++SO2+2H2O=2Fe2++BaSO4↓+4H+
【解析】解:(1.)根据图示装置可知,盛放浓硫酸的仪器为分液漏斗, 故答案为:分液漏斗;
(2.)检验装置中A、B两部分的气密性,进行的操作是:关闭弹簧夹a、打开弹簧夹b,用酒精灯在三口烧瓶下微热,观察到B中长导管口有明显气泡现象,冷却后长导管中出现一段水柱,说明该装置气密性良好,否则无法判断该装置的气密性是否良好,
故答案为:不合理;
(3.)氧气、硝酸根离子都能将二氧化硫氧化,所以如果装置中含有氧气,会干扰实验,所以排入氮气的目的是排净空气防止干扰实验,
故答案为:排净装置中的空气,防止溶液中SO2被空气中的O2氧化而干扰实验;
(4.)A.二氧化硫溶液为酸性溶液,不能使无色酚酞溶液变色,无法检验二氧化硫为酸性氧化物,故A错误;
B.二氧化硫溶液显示酸性,能够使蓝色石蕊试剂变红,可以证明二氧化硫为酸性氧化物,故B正确;
C.二氧化硫能够使红色品红溶液褪色,证明了二氧化硫漂白性,无法证明二氧化硫为酸性氧化物,故C错误;
D.KI淀粉混合溶液与二氧化硫不发生反应,无法证明二氧化硫为酸性氧化物,故D错误;
故答案为:B;
(5.)氯化铁具有氧化性,能够将二氧化硫氧化为硫酸,同时证明二氧化硫具有还原性,反应的离子方程式为:Ba2++2Fe3++SO2+2H2O=2Fe2++BaSO4↓+4H+ ,
故答案为:还原;Ba2++2Fe3++SO2+2H2O=2Fe2++BaSO4↓+4H+ .
(1)根据盛放浓硫酸的仪器的构造可知该仪器为分液漏斗;(2)必须根据冷却后长导管中是否出现水柱进行判断该装置气密性;(3)氧气能将二氧化硫氧化,所以鼓入氮气的目的是排净空气防止干扰实验;(4)证明二氧化硫为酸性氧化物,可以使用酸碱指示剂检验,如蓝色石蕊试液,而酸性溶液不能使酚酞变色,据此进行判断;(5)二氧化硫能够被铁离子氧化生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀,证明了二氧化硫具有还原性,据此写出反应的离子方程式.