题目内容
【题目】如图所示,已知A元素的最低化合价为﹣3价,它的最高价氧化物含氧56.21%,原子核内中子数比质子数多1,试回答: 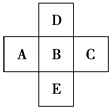
(1)写出它们的元素符号: A , B , C , D , E .
(2)A、B、C、D的气态氢化物稳定性最差的是 .
(3)A、B、C的原子半径由小到大的顺序是 .
(4)A、B、C三元素最高价氧化物对应水化物的酸性由强到弱的顺序是 .
【答案】
(1)P;S;Cl;O;Se
(2)PH3
(3)Cl<S<P
(4)HClO4>H2SO4>H3PO4
【解析】解:(1)A元素的最低化合价为﹣3价,则最高价为+5价,它的最高价氧化物为A2O5 , 含氧56.21%,设相对原子质量为x,则 ![]() ×100%=56.21%,解得x=31,故A为P元素,由元素在周期表中的位置可知,B为S,C为Cl,D为O,E为Se,所以答案是:P;S;Cl;O;Se;(2)A、B、C、D中P元素非金属性最差,故气态氢化物稳定性最差的是:PH3 , 所以答案是:PH3; (3)同周期自左而右原子半径减小,故原子半径:Cl<S<P,所以答案是:Cl<S<P;(4)同周期自左而右非金属性增强,最高价含氧酸酸性增强,故酸性:HClO4>H2SO4>H3PO4 , 所以答案是:HClO4>H2SO4>H3PO4 .
×100%=56.21%,解得x=31,故A为P元素,由元素在周期表中的位置可知,B为S,C为Cl,D为O,E为Se,所以答案是:P;S;Cl;O;Se;(2)A、B、C、D中P元素非金属性最差,故气态氢化物稳定性最差的是:PH3 , 所以答案是:PH3; (3)同周期自左而右原子半径减小,故原子半径:Cl<S<P,所以答案是:Cl<S<P;(4)同周期自左而右非金属性增强,最高价含氧酸酸性增强,故酸性:HClO4>H2SO4>H3PO4 , 所以答案是:HClO4>H2SO4>H3PO4 .

练习册系列答案
相关题目