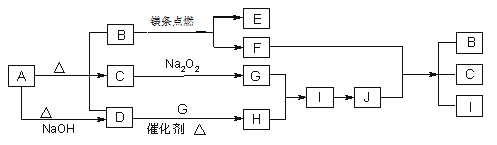
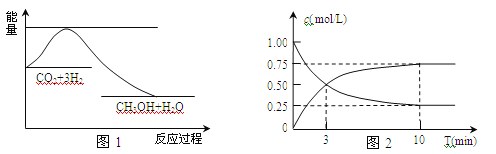
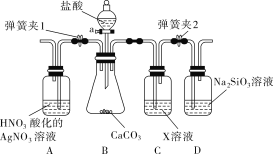
题目内容
【题目】氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L1酸性KMnO4溶液滴定未知浓度的无色NaHSO3溶液。反应的离子方程式为2![]() +5
+5![]() +H+
+H+![]() 2Mn2++5
2Mn2++5![]() +3H2O。
+3H2O。
请完成下列问题:
(1)该滴定实验所需仪器和用品是____________。
A 酸式滴定管(50 mL)B 碱式滴定管(50 mL) C 量筒(10 mL) D 锥形瓶 E 铁架台 F 滴定管夹 G 烧杯 H 白纸 I 胶头滴管 J 漏斗
(2)实验中用_____(填“酸”或“碱”)式滴定管盛装酸性KMnO4溶液,原因是_______。
(3)本实验_______(填“需要”或“不需要”)使用指示剂,滴定终点的现象是__________。
(4)①滴定前平视液面,刻度为a mL,滴定后俯视刻度为b mL,则(ba) mL比实际消耗KMnO4溶液的体积_____(填“大”或“小”),根据(ba) mL计算得到的待测液浓度比实际浓度_____(填“高”或“低”)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的待测液浓度值会____(填“偏小”“偏大”或“不变”)。
【答案】ADEFH 酸 酸性KMnO4溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管 不需要 当看到加入最后1滴KMnO4溶液,锥形瓶中溶液由无色变为浅红色(或粉红色、红色),30s不褪色,即达到滴定终点 小 低 偏大
【解析】
类比中和滴定实验,回答有关氧化还原滴定的问题:仪器用品的选择、滴定终点的判断、实验误差分析等。
(1)用0.001 mol·L1酸性KMnO4溶液滴定未知浓度的NaHSO3溶液时,通常将酸性KMnO4溶液放在酸式滴定管中,NaHSO3溶液置于锥形瓶中,滴定管用铁架台、滴定管夹固定,锥形瓶下面垫一张白纸利于观察终点溶液颜色的变化。实验所需仪器和用品有ADEFH。
(2)酸性KMnO4溶液有酸性和强氧化性,会腐蚀碱式滴定管的橡胶管,故应放在酸式滴定管中,而不能放在碱式滴定管中。
(3)本实验中,酸性KMnO4溶液呈紫(红)色,NaHSO3溶液无色,而它们反应的产物几乎无色,故不需要使用指示剂。当加入最后1滴酸性KMnO4溶液,锥形瓶中溶液由无色变为浅红色(或粉红色、紫红色),且30s不褪色,即达到滴定终点。
(4)①滴定管0刻度在上,大刻度在下,则滴定后俯视读数b mL偏小,(ba) mL比实际消耗KMnO4溶液的体积小,据此应用化学方程式计算,得到的待测液浓度比实际浓度低。
②若酸性KMnO4溶液因久置而浓度变小,则氧化一定量![]() 所消耗酸性KMnO4溶液的体积偏大,由此计算得到的
所消耗酸性KMnO4溶液的体积偏大,由此计算得到的![]() 浓度偏大。
浓度偏大。

【题目】将E(g)和F(g)加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)G(g),已知该反应的平衡常数如表所示。下列说法正确的是( )
温度/℃ | 25 | 80 | 230 |
平衡常数/(L3·mol-3) | 5×104 | 2 | 1.9×10-5 |
A.上述反应是熵增反应
B.25 ℃时,反应G(g)E(s)+4F(g)的平衡常数是0.5 mol3·L-3
C.在80 ℃时,测得某时刻,F、G的浓度均为0.5 mol·L-1,则此时v正>v逆
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大