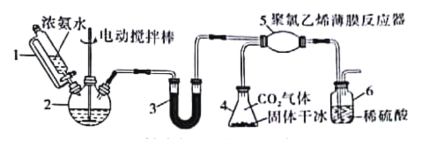
题目内容
【题目】二氧化氮可由NO和O2生成,已知在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH,n(NO)、n(O2)随时间的变化如表:
2NO2(g) ΔH,n(NO)、n(O2)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)/mol | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)已知:K800℃>K1000℃,则该反应的ΔH___0(填“大于”或“小于”),用O2表示0~2 s内该反应的平均速率为___。
(2)能说明该反应已达到平衡状态的是___。
a.容器内气体颜色保持不变 b.2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内气体密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,应采取的措施有_____。
(4)在题述条件下,计算通入2molNO和1molO2的平衡常数K=___。
(5)在题述条件下,若开始通入的是0.2molNO2气体,达到化学平衡时,NO2的转化率为__。
(6)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
①CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O ΔH<0
2N2(g)+CO2(g)+2H2O ΔH<0
②CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH<0
N2(g)+CO2(g)+2H2O(g) ΔH<0
对于反应②,欲提高NO2的转化率,可采取的措施有____。
a.增加原催化剂的表面积 b.降低温度 c.减小投料比[n(NO2)/n(CH4)] d.增大压强
【答案】小于 0.015mol·L-1·s-1 ac 通入氧气、增大压强(缩小容器体积) 720 25% bc
【解析】
(1)根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动;依据速率公式计算可得;
(2) 在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组成成分的百分含量保持不变,该反应就达到平衡状态,利用化学平衡状态的特征“等”、“定”来判断反应达到平衡状态;
(3) 该反应是一个气体体积减小的放热反应;
(4)化学平衡常数只与温度有关,而与浓度无关,温度没变,所以化学平衡常数就不变,则可以利用题给表格数据计算化学平衡常数;
(5)在题述条件下,若开始通入的是0.2molNO2气体,与题给表格数据为等效平衡;
(6)依据化学平衡移动原理分析判断。
(1)根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,由K800℃>K1000℃可知,升高温度,化学平衡常数减小,说明升高温度,平衡向逆反应方向移动,则该反应的正反应为放热反应,即ΔH<0;从0~2 s内用O2表示该反应的平均速率为v(O2)=![]() =0.015mol/(L·s),故答案为:小于;0.015mol·L-1·s-1;
=0.015mol/(L·s),故答案为:小于;0.015mol·L-1·s-1;
(2)a、该反应是在恒容的密闭容器中发生的,只有NO2是红棕色,其它气体都是无色的,若容器内颜色保持不变,说明各种气体的物质的量不变,表明反应达到平衡状态,故正确;
b、在任何时刻都存在关系:2v逆(NO)=v正(O2),不能表明反应达到平衡状态,故错误;
c、该反应是一个气体体积减小的反应,容器内压强保持不变,说明正逆反应速率相等,该反应达到了平衡状态,故正确;
d、由质量守恒定律可知,反应前后气体的质量不变,容器的容积也不变,所以任何时刻容器内气体的密度都保持不变,容器内气体密度保持不变不可作为判断平衡的标志,故错误;
ac正确,故答案为:ac;
(3) 该反应是一个气体体积减小的放热反应,为使该反应的反应速率增大,提高NO的转化率,且平衡向正反应方向移动,则应采取的措施为通入氧气来增大氧气的浓度或增大体系的压强,故答案为:通入氧气、增大压强(缩小容器体积);
(4)化学平衡常数只与温度有关,而与浓度无关,温度没变,所以化学平衡常数就不变,则可以利用题给表格数据计算化学平衡常数,由表格数据可知,平衡时,NO、O2和NO2的浓度为0.025mol/L、0.0125mol/L和0.075mol/L,平衡常数K=![]() =
=![]() =720,故答案为:720;
=720,故答案为:720;
(5)在题述条件下,若开始通入的是0.2molNO2气体,与题给表格数据为等效平衡,平衡时,各物质的浓度与表格中平衡时的效果是一样的。平衡时NO2的浓度为0.075mol/L,体积为2L,物质的量为0.075mol/L×2=0.15mol,则NO2的转化率为(0.2-0.15)/2=0.25;
也可以利用平衡常数求解。设在反应过程中c(O2)为xmol/L,则平衡时各种物质的浓度分别是c(NO2)=(0.1-2x)mol/L,c(NO)=2xmol/L,c(O2)=xmol/L,由化学平衡常数可得![]() =720,解得x=0.0125mol/L,则NO2的转化率为
=720,解得x=0.0125mol/L,则NO2的转化率为![]() ×100%=25%,故答案为:25%;
×100%=25%,故答案为:25%;
(6)反应②为一个气体体积增加的放热反应。
a、增加原催化剂的表面积,反应速率加快,化学平衡不移动,二氧化氮转化率不变,故错误;
b、降低温度,平衡向正反应方向移动,二氧化氮转化率增大,故正确;
c、减小投料比![]() ,相当于二氧化氮浓度不变,增大甲烷的浓度,增大甲烷浓度,平衡向正反应方向移动,甲烷转化率减小,二氧化氮转化率增大,故正确;
,相当于二氧化氮浓度不变,增大甲烷的浓度,增大甲烷浓度,平衡向正反应方向移动,甲烷转化率减小,二氧化氮转化率增大,故正确;
d、增大压强,平衡向逆反应方向移动,二氧化氮转化率减小,故错误;
bc正确,故答案为:bc。

 阅读快车系列答案
阅读快车系列答案