题目内容
配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一提供空轨道的粒子结合.如NH
就是由NH3(氮原子提供电子对)和H+(提供空轨道)通过配位键形成的.据此,回答下列问题:
(1)下列粒子中可能存在配位键的是
A.CO2 B.H3O+ C.CH4 D.NH
(2)硼酸(H3BO3)溶液呈酸性,试写出其电离方程式:
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:
甲: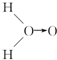 (式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
(式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
乙:HOOH化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂).
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)
 .
.
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:
+ 4 |
(1)下列粒子中可能存在配位键的是
BD
BD
.A.CO2 B.H3O+ C.CH4 D.NH
+ 4 |
(2)硼酸(H3BO3)溶液呈酸性,试写出其电离方程式:
H3BO3+H2O=H++[B(OH)4]-
H3BO3+H2O=H++[B(OH)4]-
.(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:
甲:
 (式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
(式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)乙:HOOH化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂).
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)


②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:
用无水硫酸铜检验c的反应产物中有没有水生成
用无水硫酸铜检验c的反应产物中有没有水生成
.分析:(1)判断分子中能否有提供孤电子对和空轨道的粒子;
(2)硼酸(H3BO3)溶液呈酸性是由于B中含有空轨道,OH-离子提供孤电子对的原因,以此书写离子方程式;
(3)如果存在配位键,则A为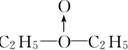 ,如为H0-OH结构,则A为C2H5-O-O-C2H5,与氢气反应的产物不同.
,如为H0-OH结构,则A为C2H5-O-O-C2H5,与氢气反应的产物不同.
(2)硼酸(H3BO3)溶液呈酸性是由于B中含有空轨道,OH-离子提供孤电子对的原因,以此书写离子方程式;
(3)如果存在配位键,则A为
 ,如为H0-OH结构,则A为C2H5-O-O-C2H5,与氢气反应的产物不同.
,如为H0-OH结构,则A为C2H5-O-O-C2H5,与氢气反应的产物不同.解答:解:(1)H3O+中O提供孤电子对,H+提供空轨道,NH4+中N提供孤电子对,H+提供空轨道,二者都能形成配位键,
故答案为:BD;
(2)硼原子为缺电子原子,H3BO3的电离是B原子和水电离的OH-形成配位键,水电离的H+表现酸性,反应的离子方程式为H3BO3+H2O=H++[B(OH)4]-,
故答案为:H3BO3+H2O=H++[B(OH)4]-;
(3)①如果H2O2的结构如甲所示,实验c中A为 ,与氢气反应生成乙醚,方程式为
,与氢气反应生成乙醚,方程式为 ,
,
故答案为: ;
;
②如为H0-OH结构,则A为C2H5-O-O-C2H5,与氢气反应生成乙醇,所以可用用无水硫酸铜检验c的反应产物中有没有水生成,如硫酸铜不变蓝,说明没有水生成,则说明过氧化氢中不含配位键,否则含有配位键,
故答案为:用无水硫酸铜检验c的反应产物中有没有水生成.
故答案为:BD;
(2)硼原子为缺电子原子,H3BO3的电离是B原子和水电离的OH-形成配位键,水电离的H+表现酸性,反应的离子方程式为H3BO3+H2O=H++[B(OH)4]-,
故答案为:H3BO3+H2O=H++[B(OH)4]-;
(3)①如果H2O2的结构如甲所示,实验c中A为
 ,与氢气反应生成乙醚,方程式为
,与氢气反应生成乙醚,方程式为 ,
,故答案为:
 ;
;②如为H0-OH结构,则A为C2H5-O-O-C2H5,与氢气反应生成乙醇,所以可用用无水硫酸铜检验c的反应产物中有没有水生成,如硫酸铜不变蓝,说明没有水生成,则说明过氧化氢中不含配位键,否则含有配位键,
故答案为:用无水硫酸铜检验c的反应产物中有没有水生成.
点评:本题考查我们对物质结构理论知识的掌握情况,题目以配位键作为信息考查学生的思维能力,要求我们通过阅读文字分析出配位键形成的实质,涉及的知识点有CO2、H3O+、CH4、H2SO4等物质的结构,以及对H3BO3电离的分析,注意硼原子为缺电子原子,H3BO3的电离是B原子和水电离的OH-形成配位键,水电离的H+表现酸性,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
