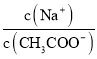题目内容
【题目】下列说法正确的是( )
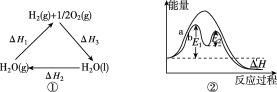
A. 图①中ΔH1=ΔH2+ΔH3
B. 图②在催化剂条件下,反应的活化能等于E1+E2
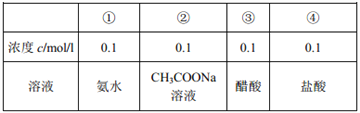
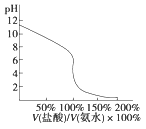
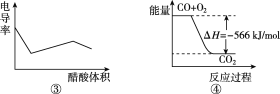
C. 图③表示醋酸溶液滴定 NaOH溶液和氨水混合溶液的电导率变化曲线
D. 图④可表示由CO(g)生成CO2(g)的过程中要放出566 kJ 热量
【答案】C
【解析】
试题根据盖斯定律来可知:一个反应无论是一步完成还是分为数步完成,其热效应是相同的,故应有:△H1=-△H2-△H3,A错误;E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,B错误;氢氧化钠是强电解质,氨水是弱电解质,滴加的弱电解质先和氢氧化钠反应生成强电解质醋酸钠,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氢氧化钠完全被中和后,醋酸继续与弱电解质氨水反应生成强电解质醋酸铵,所以电导率增大;氨水也完全反应后,继续滴加醋酸,因为溶液被稀释,电导率有下降趋势,C正确;图象中未标明CO、氧气以及CO2的物质的量与焓变的值的数值计量关系,D错误。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、量筒、0.5mol·L-1盐酸、0.55mol·L-1NaOH溶液,实验尚缺少的玻璃用品是__。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒__(填“能”或“否”),其原因是__。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50mL0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1溶液 | 20℃ | 23.3℃ | |
② | 50mL0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1HCl溶液 | 20℃ | 23.5℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ·℃-1·kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。___
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:__。