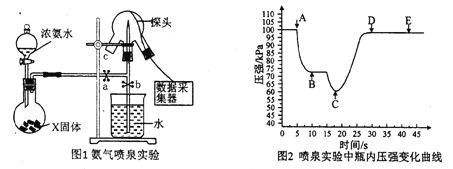
题目内容
【题目】如图所示,横轴为溶液的pH,纵轴为Zn2+或ZnO22-物质的量浓度的对数。回答下列问题:
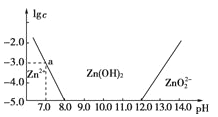
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为__________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是________。
【答案】(1)Zn2++4OH-==ZnO22-+2H2O (2)10-17 (3)8.0~12.0
【解析】
试题分析:(1)由图像可知溶液的碱性较强时,锌的存在形式为ZnO22-,所以其反应的离子方程式为Zn2++4OH-===ZnO22-+2H2O,
(2)当溶液的pH=7.0时,c(Zn2+)=10-3molL-1,Ksp = c(Zn2+) · c2(OH-) = 10-3 (10-7)2=10-17;
(3)根据图像知,溶液的pH范围为8<pH<12时,可将Zn2+转化为Zn(OH)2沉淀,溶液中锌离子浓度小于10-5 molL-1,可以近似认为锌离子不存在;所以为提取Zn2+离子可以控制溶液中pH值的范围是8.0<pH<12.0。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目