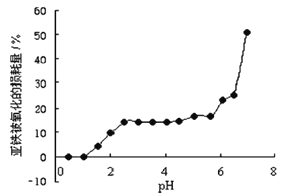
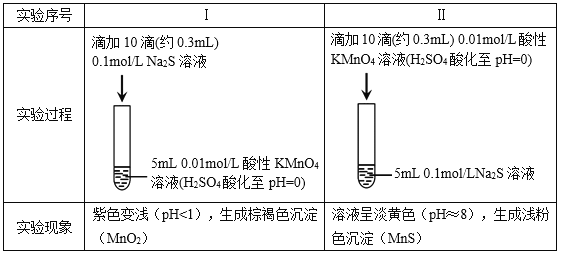
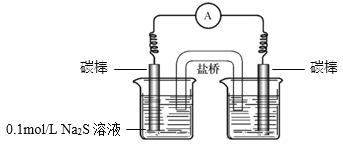
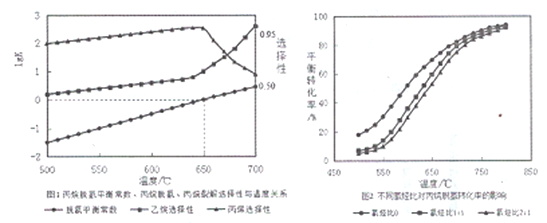
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ¥”ΖœΨ…“ΚΨßœ‘ ΨΤςΒΡ÷ς≤Ρ ITOΘ®÷ς“Σ≥…Ζ÷ «Κ§νςΓΔΈΐΒΡ―θΜ·ΈοΘ©ΜΊ ’νςΚΆΈΐΘ§Νς≥Χ Ψ“βΆΦ»γœ¬ΓΘ

Ή ΝœΘΚ
Έο÷ | νςΘ®InΘ© | ΈΐΘ®SnΘ© |
÷ήΤΎ±μΈΜ÷Ο | ΒΎΈε÷ήΤΎΓΔΒΎIIIAΉε | ΒΎΈε÷ήΤΎΓΔΒΎIVAΉε |
―’…ΪΓΔΉ¥Χ§ | “χΑΉ…ΪΙΧΧε | “χΑΉ…ΪΙΧΧε |
”κάδΥαΉς”Ο | ΜΚ¬ΐΖ¥”Π | ΜΚ¬ΐΖ¥”Π |
”κ«ΩΦν»ή“Κ | ≤ΜΖ¥”Π | Ζ¥”Π |
Θ®1Θ©ΈΣΝΥΦ”Ωλ≤Ϋ÷ηΔΌΒΡΖ¥”ΠΥΌ¬ Θ§Ω…“‘≤…»ΓΒΡ¥κ ©”–______Θ®÷Ν…Ό¥πΝΫΒψΘ©ΓΘ
Θ®2Θ©≤Ϋ÷ηΔΌ÷–νςΒΡ―θΜ·ΈοΉΣΜ·≥…In3+ΒΡάκΉ”ΖΫ≥Χ Ϋ «______ΓΘ
Θ®3Θ©≤Ϋ÷ηΔΎ÷–Φ”»κΙΐΝΩνςΡήΙΜ≥ΐ»Ξ»ή“Κ÷–ΒΡSn2+Θ§ΗυΨίΥυΗχΉ ΝœΖ÷ΈωΤδ‘≠“ρ «______ΓΘ
Θ®4Θ©≤Ϋ÷ηΔήΚΆΔί÷–NaOH»ή“ΚΒΡΉς”Ο «______ΓΘ
Θ®5Θ©œ¬ΆΦ «ΡΘΡβΨΪΝΕνςΒΡΉΑ÷ΟΆΦΘ§«κ‘ΎΖΫΩρ÷–Χν–¥œύ”ΠΒΡΈο÷ ΓΘ_____
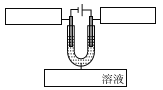
ΓΨ¥πΑΗΓΩ ‘ω¥σ―ΈΥα≈®Ε»ΓΔΦ”»»ΓΔΫΪΖœΝœΖέΥι In2O3+6H+==2In3++3H2O Ά§÷ήΤΎ÷ςΉε‘ΣΥΊ¥”Ήσœρ”“‘≠Ή”ΑκΨΕΦθ–ΓΘ§Ϋπ τ–‘Φθ»θΘ®ΜΙ‘≠–‘Φθ»θΘ© ≥ΐ»ΞaΓΔbΝΫ÷÷¬Υ‘ϋ÷–ΒΡΈΐΚΆ–Ω 
ΓΨΫβΈωΓΩΘ®1Θ©Φ”ΩλΖ¥”ΠΥΌ¬ Θ§Ω…≤…”Ο‘ω¥σΖ¥”ΠΈο≈®Ε»Θ§…ΐΈ¬Μρ‘ω¥σΙΧΧε”κ“ΚΧεΒΡΫ”¥ΞΟφΜΐΒ»ΖΫΖ®ΓΘΙ ¥πΑΗΈΣΘΚ‘ω¥σ―ΈΥα≈®Ε»ΓΔΦ”»»ΓΔΫΪΖœΝœΖέΥιΘΜ
Θ®2Θ©œρΖœΝœ÷–Φ”―ΈΥαΘ§νςΓΔΈΐΒΡ―θΜ·Έο»ήΫβ…ζ≥…In3+ΓΔSn2+Θ§‘ρνςΒΡ―θΜ·Έο÷–InΈΣ+3ΦέΘ§Τδ―θΜ·ΈοΒΡΜ·―ß ΫΈΣIn2O3ΓΘ―θΜ·ΈοΉΣΜ·≥…In3+Θ§άκΉ”ΖΫ≥Χ Ϋ «In2O3+6H+=2In3++3H2OΘΜ
Θ®3Θ©ΗυΨί±μΗώΉ ΝœΩ…÷ΣΘ§In”κSnΈΣΆ§÷ήΤΎ‘ΣΥΊΓΘΆ§÷ήΤΎ÷ςΉε‘ΣΥΊ¥”Ήσœρ”“‘≠Ή”ΑκΨΕΦθ–ΓΘ§Ϋπ τ–‘Φθ»θΘ®ΜΙ‘≠–‘Φθ»θΘ©Θ§‘ρInΫπ τ–‘«Ω”ΎSnΓΘœρ»ή“Κ÷–Φ”»κΙΐΝΩΒΡInΘ§InΡήΙΜ”κSn2+Ζ¥”Π…ζ≥…SnΓΘ
Θ®4Θ©Νς≥ΧΖ÷ΈωΘΚ≤Ϋ÷ηΔΌΥαΫΰΘ§Φ”―ΈΥαΫΪνςΓΔΈΐΒΡ―θΜ·Έο»ήΫβΘ§ΒΟΒΫΚ§In3+ΓΔSn2+ΒΡ¬Υ“ΚΓΘ≤Ϋ÷ηΔΎΘ§Φ”»κΙΐΝΩΒΡInΘ§In”κSn2+Ζ¥”Π÷ΟΜΜ≥ωSnΘ§…ζ≥…In3+Θ§Ιΐ¬ΥΘ§¬Υ‘ϋaΒΡ÷ς“Σ≥…Ζ÷ΈΣSnΚΆΈ¥Ζ¥”ΠΆξΒΡInΘ§¬Υ“ΚΈΣIn3+»ή“ΚΓΘ≤Ϋ÷ηΔέΘ§œρ¬Υ“Κ÷–Φ”»κΙΐΝΩΒΡZnΘ§Zn”κIn3+Ζ¥”Π÷ΟΜΜ≥ωInΘ§Ιΐ¬ΥΥυΒΟ¬Υ‘ϋbΒΡ÷ς“Σ≥…Ζ÷ΈΣInΚΆΈ¥Ζ¥”ΠΆξΒΡZnΓΘ≤Ϋ÷ηΔίΘ§œρ¬Υ‘ϋb÷–Φ”»κΙΐΝΩΒΡNaOH»ή“ΚΘ§In”κNaOH≤ΜΖ¥”ΠΘ§Zn”κNaOHΖ¥”Π…ζ≥…“Ή»ή”ΎΥ°ΒΡZnO22-Θ§ Βœ÷Zn”κInΖ÷άκΓΘ≤Ϋ÷ηΔήΘ§œρ¬Υ‘ϋa÷–Φ”»κΙΐΝΩNaOH»ή“ΚΘ§Sn”κNaOHΖ¥”ΠΘ§ΕχIn≤ΜΖ¥”ΠΘ§‘ρ¥οΒΫ ΙSnΚΆInΖ÷άκΒΡΡΩΒΡΓΘΗυΨί…œ ωΖ÷ΈωΘ§≤Ϋ÷ηΔήΚΆΔίΦ”»κNaOH»ή“ΚΒΡΡΩΒΡΈΣ≥ΐ»ΞaΓΔbΝΫ÷÷¬Υ‘ϋ÷–ΒΡΈΐΚΆ–ΩΓΘ
Θ®5Θ©ΨΪΝΕInΘ§Ω…“‘ΝΣœκΨΪΝΕCuΒΡΉΑ÷ΟΓΘΫΪ¥÷In(99.000ΘΞ)Ής―τΦΪΘΜ¥ΩInΉς“θΦΪΘΜΒγΫβ÷ »ή“ΚΈΣΚ§In3+ΒΡ»ή“ΚΘ§ΉΑ÷ΟΆΦΩ…±μ ΨΈΣΘΚ ΓΘ
ΓΘ

ΓΨΧβΡΩΓΩΈΣΧα¥Ωœ¬Ν–Έο÷ Θ®ά®Κ≈ΡΎΈΣ‘”÷ Θ©Θ§ Ι”ΟΒΡ ‘ΦΝΚΆΖ÷άκΖΫΖ®ΕΦ’ΐ»ΖΒΡ «Θ® Θ©
Έο÷ | ‘ΦΝ | Ζ÷άκΖΫΖ® | |
ΔΌ | œθΥαΦΊΘ®¬»Μ·ΡΤΘ© | ’τΝσΥ° | ΫΒΈ¬ΫαΨß |
ΔΎ | Εΰ―θΜ·ΧΦΘ®¬»Μ·«βΘ© | ±ΞΚΆΧΦΥαΡΤ»ή“Κ | œ¥Τχ |
Δέ | ““¥ΦΘ®Υ°Θ© | …ζ ·Μ“ | ’τΝσ |
Δή | ¬»Μ·οßΘ®¬»Μ·ΧζΘ© | «β―θΜ·ΡΤ»ή“Κ | Ιΐ¬Υ |
A.ΔΌΔΎB.ΔΌΔέC.÷Μ”–ΔέD.ΔέΔή