题目内容
8.某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用铁丝固定的干燥管,内装块状碳酸钙固体;D为气球; E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.(1)实验时,先将B装置放入A中,使碳酸钙与稀硝酸相接触产生气体,直到C处澄清石灰水出现白色沉淀为止,将B装置上提,使之与稀硝酸分离.该组学生设计此步操作的目的是产生二氧化碳,排出装置中的空气;
(2)然后将铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;用F向E中鼓入空气,可观察到 红棕色气体 出现,产生上述现象其反应的化学方程式为2NO+O2=NO2;一段时间后,C中白色沉淀溶解,其原因可能是二氧化碳密度大于空气,未能排尽烧瓶中的空气,少量NO与空气中的氧气反应生成少量的红棕色的NO2;鼓入空气后,NO与氧气反应,生成大量的红棕色气体二氧化氮 (请用最熟悉的反应进行解释);
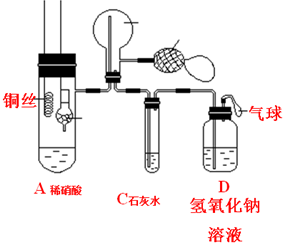
(3)溶液D的作用是吸收尾气,防止污染大气.
分析 要验证铜与稀硝酸反应生成一氧化氮,则应将装置中的O2排出.当B中的CaCO3与稀硝酸接触时,生成CO2气体.CO2气体可将A中空气排尽,但由于CO2的密度大于空气的密度,因此E中采用向下排空气法是不能将空气排尽的.由于E中有残留的少量O2,因此当有NO生成时,E中有少量的NO2生成,从F鼓入空气时,E中生成的NO2增加,红棕色加深.随着反应的不断进行,E中生成的NO2会被排入C,在C中与水反应生成硝酸,将原来生成的CaCO3沉淀溶解.D装置用来吸收尾气,防止污染环境.
解答 解:(1)当B中的CaCO3与稀硝酸接触时,生成CO2气体.CO2气体可将A中空气排尽,以防止氧化生成的NO,故答案为:产生二氧化碳,排出装置中的空气;
(2)A中产生无色气体为NO,反应的化学方程式为3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,一氧化氮和氧气反应生成红棕色气态二氧化氮,反应的化学方程式为:2NO+O2=NO2,由于CO2的密度大于空气的密度,因此E中采用向下排空气法是不能将空气排尽的.由于E中有残留的少量O2,因此当有NO生成时,E中有少量的NO2生成,从F鼓入空气时,E中生成的NO2增加,红棕色加深,
故答案为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,2NO+O2=NO2,二氧化碳密度大于空气,未能排尽烧瓶中的空气,少量NO与空气中的氧气反应生成少量的红棕色的NO2;鼓入空气后,NO与氧气反应,生成大量的红棕色气体二氧化氮;
(3)D装置用来吸收尾气,防止污染环境,
故答案为:吸收尾气,防止污染大气.
点评 本题综合考查物质的性质实验探究,涉及硝酸与铜的反应以及一氧化氮的性质,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度不大.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案| A. | 若a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| B. | 若a1=a2,b1=2b2,则混合溶液中c(CH3COO-)>c(CH3COOH)>c(Na+) | |
| C. | 若a1b1>a2b2,则混合液的pH一定大于7 | |
| D. | a1=a2,且混合溶液的pH<7,则b1一定大于b2 |

| A. | 溶液中HCO3-的数目 | B. | 溶液的pH | ||
| C. | CO32- 水解的平衡常数 | D. | 溶液中的c(CO32-) |
| A. | NO3-、Cl-、Fe3+、K+ | B. | Cl-、Ag+、NO3-、Na+ | ||
| C. | SO42-、Al3+、Na+、Cl- | D. | NO3-、HCO3-、Na+、SO42- |
【实验】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
【提出假设】
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
【设计实验方案验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验 方案 | 实验操作 | 实验 现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变 成红色 | 白色物 质为 Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白 色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显 现象 |
(1)写出金属镁与二氧化碳反应的化学反应方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(2)甲同学认为方案1得到的结论不正确,其理由是Na2CO3溶液显碱性,也会使酚酞变红,且也有可能是Na2O和Na2CO3的混合物.
(3)乙同学认为方案2得到的结论正确,白色物质为Na2CO3.
(4)通过方案1和方案2的实验,你认为上述三个假设中,假设2成立.你的理由是方案2①中出现的白色沉淀是CaCO3或Ca(OH)2;方案2②中滴加无色酚酞试液无明显现象,说明燃烧后的白色产物中没有Na2O存在,所以燃烧后的白色产物中仅有Na2CO3,白色沉淀为CaCO3.
(5)钠在二氧化碳中燃烧的化学方程式为4Na+3CO2=2Na2CO3+C.
(6)丙同学认为白色物质有可能是氢氧化钠.你是否同意丙同学的观点,并简述理由:不同意,因为反应物中无氢元素,违背质量守恒定律.

| A. | 加入催化剂时,该反应的反应热发生改变 | |
| B. | 升高温度,利于A的转化率增大 | |
| C. | 该反应的正反应为放热反应 | |
| D. | 增大压强,能够加快反应达到平衡状态的速率 |
| A. | O2完全转化为SO3 | |
| B. | SO2、O2、SO3同时存在 | |
| C. | SO2、O2与SO3的浓度不再随时间变化 | |
| D. | SO2、O2与SO3的物质的量之比为2:1:2 |
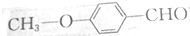 )的同分异构体既能发生银镜反应,又能与FeCl3溶液发生显色反应的有13种.
)的同分异构体既能发生银镜反应,又能与FeCl3溶液发生显色反应的有13种.