题目内容
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO![]() 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是( )
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是( )
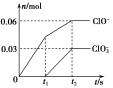
A.苛性钾溶液中KOH的物质的量是0.09 mol
B.ClO![]() 的生成是由于氯气的量的多少引起的
的生成是由于氯气的量的多少引起的
C.在酸性条件下ClO-和ClO![]() 可生成Cl2
可生成Cl2
D.反应中转移电子的物质的量是0.21 mol
【答案】D
【解析】根据图像可知反应后,生成KClO和KClO3分别是0.06 mol和0.03 mol,则根据电子得失守恒可知,生成氯化钾是0.06 mol×1+0.03 mol×5=0.21 mol,所以D正确,A不正确,应该是0.3 mol;B不正确,应该和温度有关系;C不正确,两种离子不可能都得到电子。

【题目】(1)下列反应中,属于放热反应的是________,属于吸热反应的是________(填序号)。
①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)用铜、银与硝酸银设计一个原电池,负极的电极反应式是_______________。
(3)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25 g,铜表面析出了氢气________L(标准状况)。
(4)现在同学们学过了取代反应、加成反应,请将下列物质发生的反应填写在下表中。
①由乙烯制1,2-二氯乙烷;②乙烷与氯气光照;③乙烯使溴的四氯化碳溶液褪色;
④乙烯通入酸性高锰酸钾溶液;⑤由苯制取溴苯;⑥乙烷在空气中燃烧;
⑦由苯制取硝基苯;⑧由苯制取环己烷
反应类型 | 取代反应 | 加成反应 |
反应 | _____ | ______ |
(5)某烃在标准状况下的密度为3.215 g/L,现取3.6 g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4 g,碱石灰增重11 g,则:
①该烃分子的摩尔质量______。
②该烃的分子式________。
③若该烃的一氯代物只有一种,则该烃的结构简式为______。