题目内容
【题目】(1)下列反应中,属于放热反应的是________,属于吸热反应的是________(填序号)。
①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)用铜、银与硝酸银设计一个原电池,负极的电极反应式是_______________。
(3)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25 g,铜表面析出了氢气________L(标准状况)。
(4)现在同学们学过了取代反应、加成反应,请将下列物质发生的反应填写在下表中。
①由乙烯制1,2-二氯乙烷;②乙烷与氯气光照;③乙烯使溴的四氯化碳溶液褪色;
④乙烯通入酸性高锰酸钾溶液;⑤由苯制取溴苯;⑥乙烷在空气中燃烧;
⑦由苯制取硝基苯;⑧由苯制取环己烷
反应类型 | 取代反应 | 加成反应 |
反应 | _____ | ______ |
(5)某烃在标准状况下的密度为3.215 g/L,现取3.6 g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4 g,碱石灰增重11 g,则:
①该烃分子的摩尔质量______。
②该烃的分子式________。
③若该烃的一氯代物只有一种,则该烃的结构简式为______。
【答案】 ②③④⑤⑥ ① Cu-2e-===Cu2+ 1.12 ②⑤⑦ ①③⑧ 72 g·mol-1 C5H12 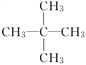
【解析】(1)①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)是分解反应,属于常见的吸热反应;②燃烧木炭取暖是物质的燃烧,放出热量,属于常见的放热反应;③炸药爆炸要放出热量,属于放热反应;④酸与碱的中和反应要放热热量,属于常见的放热反应;⑤生石灰与水作用制熟石灰,是化合反应,放出热量,属于常见的放热反应;⑥食物因氧化而腐败要放热热量,属于放热反应;属于放热反应的是②③④⑤⑥ ;属于吸热反应的是①;(2)用铜、银与硝酸银设计一个原电池,根据金属的活泼性判断,铜作负极,铜失去电子变成离子进入溶液,发生氧化反应,Cu-2 e - =Cu2+ ;银作正极,银离子得电子生成银单质,发生还原反应,2Ag + +2 e - =2Ag;两个电极反应式相加即得总反应方程式,Cu+2Ag + =2Ag+Cu 2+ .故负极的电极反应式是 Cu-2 e - =Cu2+ ;(3)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:Zn-2e-=Zn2+,铜为正极,电极反应为2H++2e-=H2↑,锌片的质量减少了3.25克,则物质的量为3.25g/65g·mol-1=0.05mol,转移的电子的物质的量为n(e-)=2n(Zn)=2n(H2)=2×0.05mol=0.1mol,则:V(H2)=0.05mol×22.4L·mol-1=1.12L;(4)①由乙烯制1,2-二氯乙烷,为加成反应;②乙烷与氯气光照生成氯乙烷等卤代烃,为取代反应;③乙烯使溴的四氯化碳溶液褪色,发生加成反应;④乙烯通入酸性高锰酸钾溶液,发生氧化还原反应;⑤由苯制取溴苯,发生取代反应;⑥乙烷在空气中燃烧生成水和二氧化碳,为氧化还原反应;⑦由苯制取硝基苯,为取代反应;⑧由苯制取环己烷,为加成反应,故取代反应②⑤⑦;加成反应①③⑧;(5)①公式M = ρ·Vm,其中Vm = 22.4L·mol-1,由已知可以确定出该烃的摩尔质量 M = 3.215 * 22.4 = 72 g·mol-1;(2)∵水的物质的量n(H2O) = 5.4/18 = 0.3 mol,CO2的物质的量n(CO2) = 11/44 = 0.25 mol,烃的物质的量n(烃) = 3.6/72 = 0.05 mol,∴氢原子的物质的量 n(H) = 2·n(H2O) = 2 * 0.3 = 0.6 mol,碳原子的物质的量 n(C) = n(CO2) = 0.25 mol,∴氢原子数N(H) = 0.6/0.05 = 12,碳原子数N(C) = 0.25/0.05 = 5,∴该烃的分子式为C5H12;③若该烃的一氯代物只有一种,则该烃的结构简式为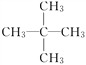 。
。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案